Punti salienti In questo studio, gli autori hanno utilizzato un metodo Delphi modificato per ottenere il consenso degli esperti sulla definizione e sulle categorie di gravità dell’esacerbazione della malattia polmonare ostruttiva cronica (BPCO). Il gruppo di esperti ha proposto di incorporare valori clinici e di laboratorio misurabili, tra cui la gravità della dispnea, la saturazione di ossigeno, la frequenza respiratoria, la frequenza cardiaca, la proteina C-reattiva e l’emogasanalisi. Questa definizione aggiornata, denominata "proposta di Roma" , aiuterà a standardizzare la cura dei pazienti con diagnosi di riacutizzazione della BPCO e ad omogeneizzare la ricerca. |
Dove siamo?
Conoscenze scientifiche sull’argomento:
Se si vuole che i medici possano diagnosticare e curare efficacemente i pazienti, fornire informazioni prognostiche e implementare la medicina di precisione, sono necessarie definizioni precise e pratiche per gli eventi medici acuti. L’attuale definizione di esacerbazione della broncopneumopatia cronica ostruttiva (BPCO) è soggettiva e si basa esclusivamente sul peggioramento dei sintomi respiratori. Inoltre, la gravità viene classificata post hoc dalla risorsa sanitaria utilizzata per trattare l’evento. Queste carenze giustificano la necessità di rivedere la definizione di ECOPD.
Cosa aggiunge questo studio al campo:
La proposta di Roma per una definizione aggiornata di ECOPD affronta molte delle carenze delle definizioni precedenti. Basato su un’ampia revisione della letteratura e utilizzando la metodologia Delphi, specifica il periodo di tempo entro il quale il peggioramento dei sintomi definisce un ECOPD.
In secondo luogo, al peggioramento soggettivo dei sintomi aggiunge una serie di variabili cliniche oggettivamente misurabili e facilmente disponibili : dispnea, saturazione di ossigeno, frequenza respiratoria, frequenza cardiaca, proteina C-reattiva e, se necessario, emogasanalisi.
In terzo luogo, sulla base di soglie concordate, integra queste variabili in tre categorie di gravità mutuamente esclusive che possono essere utilizzate per classificare la gravità della riacutizzazione al contatto iniziale con il paziente. Questa proposta mira a facilitare e migliorare l’assistenza clinica, la ricerca e la pianificazione dei servizi sanitari.
L’attuale definizione di esacerbazione della broncopneumopatia cronica ostruttiva (BPCO) si basa esclusivamente sul peggioramento dei sintomi respiratori, con gravità classificata post hoc dalla risorsa sanitaria utilizzata per trattare l’evento, che può variare a seconda dei professionisti e dei sistemi. sanitario.
Queste carenze supportano la necessità di rivedere la definizione ECOPD e la classificazione della gravità per renderla utile al momento del contatto con il paziente. Per raggiungere questo obiettivo, un gruppo di esperti ha utilizzato un metodo Delphi modificato composto da cinque serie di domande generate da un’esaustiva revisione della letteratura, integrata da discussioni virtuali. Per le 80 domande identificate, il livello di accordo è stato valutato utilizzando una scala Likert da 0 (fortemente in disaccordo) a 9 (fortemente d’accordo). Il consenso è stato definito a priori come un punteggio mediano ≥ 7 (forte accordo).
Il modello concettuale della ECOPD e la definizione proposta
Le prove attuali indicano che un ECOPD è caratterizzato da un’esplosione acuta di infiammazione delle vie aeree dovuta a batteri, virus, inquinanti ambientali o altri stimoli (Figura 1). Ciò è stato documentato da studi accurati condotti in ambito ambulatoriale e ospedaliero, dove molti studi dimostrano che il processo infiammatorio può diffondersi a livello sistemico.
Questa esplosione infiammatoria, insieme al peggioramento della limitazione esistente del flusso aereo, aumenta il lavoro respiratorio nei pazienti con riserva respiratoria limitata.
Un circolo vizioso di aumento della resistenza delle vie aeree e tachipnea porta all’intrappolamento di gas nei polmoni, disfunzione dei muscoli respiratori, peggioramento della dispnea e disadattamento ventilazione-perfusione che si manifesta come ipossiemia arteriosa con o senza ipercapnia . In alcuni pazienti, la domanda ventilatoria supera la riserva, portando a insufficienza ventilatoria, ipercapnia e acidosi respiratoria che, se non trattata, può causare la morte.
Metodo diagnostico
1) Questi eventi possono essere pericolosi per la vita e richiedono una valutazione e un trattamento adeguati.
2) Completare una valutazione clinica approfondita per evidenziare la presenza di BPCO e possibili comorbilità respiratorie e non respiratorie, inclusa la considerazione di cause alternative per i sintomi e i segni del paziente; principalmente polmonite, insufficienza cardiaca ed embolia polmonare.
3) Valutare:
a) Sintomi; gravità della dispnea mediante VAS e documentazione della presenza di tosse.
b) Segni (tachipnea, tachicardia), volume e colore dell’espettorato e difficoltà respiratoria (uso dei muscoli accessori).
4) Valutare la gravità mediante adeguate indagini aggiuntive quali: pulsossimetria, valutazione di laboratorio, PCR e/o emogasanalisi.
5) Stabilire la causa dell’evento (virus, batterica, ambientale, altro).
Cause, meccanismi patobiologici e conseguenze fisiopatologiche in una riacutizzazione della BPCO
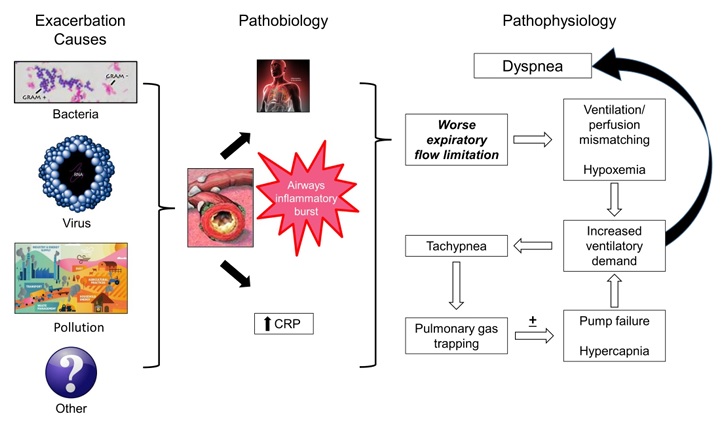
BPCO, malattia polmonare cronica ostruttiva; VAS, scala analogica visiva; CRP, proteina C-reattiva.
Definizioni
| La definizione proposta recita: "In un paziente con BPCO, una riacutizzazione è un evento caratterizzato da dispnea e/o tosse ed espettorato che peggiora in ≤14 giorni, che può essere accompagnato da tachipnea e/o tachicardia, spesso associati ad aumento locale e infiammazione sistemica causata da infezione delle vie respiratorie, inquinamento o altri danni alle vie respiratorie”. |
Classificazione della gravità ECOPD
L’attuale classificazione della gravità dell’ECOPD, basata sull’utilizzo post-fatto delle risorse sanitarie, rappresenta una limitazione importante della definizione attuale. A causa della variabilità globale delle risorse disponibili per curare i pazienti e delle usanze locali che influenzano i criteri per le visite e i ricoveri ospedalieri, esiste una sostanziale variabilità nei risultati riportati dall’ECOPD. Ciò è di particolare importanza nell’interpretazione dei risultati degli studi di intervento e nella pianificazione di futuri studi clinici.
Tre categorie di gravità (lieve, moderata o grave) sono state definite integrando sei variabili clinicamente misurabili:
- Intensità della dispnea
- Saturazione di ossigeno
- Frequenza respiratoria
- Frequenza cardiaca
- proteina C-reattiva
- Se indicato, emogasanalisi arteriosa.
Queste variabili sono state concordate per consenso da un possibile elenco di 21 che sono state oggetto di un’esaustiva revisione e discussione della letteratura. Di queste possibili variabili, il peggioramento della tosse e dell’espettorato meritava un’attenzione particolare. Durante l’ECOPD possono verificarsi tosse e aumento dell’espettorato o cambiamento di colore e, in una percentuale di casi, possono essere il sintomo o segno più rilevante; tuttavia, la sua intensità non è stata misurata correttamente, rendendo difficile l’inclusione nella classificazione di gravità dell’ECOPD.
Tuttavia, sebbene la tosse e l’espettorato rimangano parte integrante della definizione di ECOPD, i relatori hanno convenuto che il peggioramento della dispnea è il sintomo più rilevante per la maggior parte dei pazienti e, poiché è misurabile, è utile classificare la gravità dell’episodio.
Ipossiemia e ipercapnia
Lo squilibrio ventilazione-perfusione (VA/Q) è il meccanismo più importante responsabile delle anomalie degli scambi gassosi nella BPCO.
Poiché la BPCO stabile può essere associata a ipossiemia arteriosa con o senza ipercapnia, sia le misurazioni assolute che la variazione dei valori sarebbero utili come determinanti della gravità. La valutazione dei gas nel sangue è ideale ma non è disponibile in tutti i contesti clinici, mentre la pulsossimetria è pratica e ampiamente disponibile, anche se riconosciamo che potrebbe essere meno accurata nei pazienti neri.
È noto che l’insufficienza respiratoria ipercapnica scompensata è associata ad un aumento della mortalità che viene ridotta dalla ventilazione non invasiva (NIV). Sebbene le società di esperti raccomandino di titolare l’ossigeno supplementare durante l’ECOPD a una SaO2 compresa tra l’88 e il 92% (7, 55), gli studi dell’ECOPD suggeriscono che la riduzione media della SaO2 non era superiore al 2%.
Sulla base di queste evidenze, il panel ha concordato che, quando la variazione rispetto al basale è nota, un ECOPD lieve sarebbe caratterizzato da una saturazione arteriosa di ossigeno (SaO2) ≥92% e una variazione ≤3%, un evento moderato sarebbe una SaO2 <92% e una variazione ≤3%. /o una variazione > 3%, e un evento grave dovuto a insufficienza respiratoria ipercapnica acidotica , cioè pressione parziale arteriosa dell’anidride carbonica (PaCO2) > 45 mmHg e pH < 7,35.
Proteina C-reattiva sierica
Un valore di PCR ≥ 10 mg/L può aiutare a distinguere l’ECOPD lieve da quella moderata.
I soggetti sani, i fumatori senza BPCO e i pazienti con BPCO stabile presentano tipicamente valori di PCR <10 mg/L, con valori più elevati all’interno di questo intervallo associati ad un aumentato rischio di ospedalizzazione e morte. I livelli sierici di CRP aumentano nell’ECOPD sia virale che batterico, sebbene siano solitamente più alti in quest’ultimo, quindi i valori del punto di cura possono essere utilizzati per guidare la terapia antibiotica.
Nei pazienti ambulatoriali con BPCO che soffrono di ECOPD, i livelli di PCR aumentano modestamente rispetto ai valori basali. Nei pazienti ricoverati al pronto soccorso o ricoverati in ospedale sono stati segnalati valori di PCR più elevati, compresi tra 8 e 156 mg/L.
Sebbene il panel abbia riconosciuto la mancanza di specificità della CRP sierica come indicatore di infiammazione delle vie aeree o dei polmoni, è stato raggiunto il consenso sul fatto che un valore di CRP ≥ 10 mg/L può aiutare a distinguere l’ECOPD lieve da quella moderata. .
Non abbiamo assegnato alla CRP un peso diverso da HR, RR o saturazione di ossigeno. Un paziente potrebbe avere un episodio più grave definito esclusivamente da una combinazione di segni clinici senza una CRP > 10 mg/L. La nostra proposta mira a contribuire a guidare l’inclusione di almeno un indicatore misurabile del punto di cura, la cui soglia può essere modificata nel tempo, se questa proposta viene implementata e i risultati lo suggeriscono.
Integrazione delle variabili in una scala pratica di valutazione della gravità
I relatori hanno convenuto che l’integrazione di cinque parametri facili da valutare (dispnea, frequenza respiratoria, frequenza cardiaca, saturazione di ossigeno e CRP sierica) sarà utilizzata per valutare la gravità di un ECOPD, sia nella valutazione clinica dei pazienti che nella valutazione ricerca. e studi clinici.
|
La proposta di Roma per una definizione aggiornata e una classificazione della gravità dell’ECOPD è stata elaborata da un gruppo internazionale di esperti, utilizzando un quadro incentrato sulla fattibilità e sulla potenziale validità. Il consenso è stato raggiunto utilizzando una metodologia Delphi modificata, basata su dati provenienti da studi che riportavano misurazioni oggettive di sintomi, segni, variabili fisiologiche e biomarcatori.
Il valore predittivo delle variabili che classificano la gravità è stato valutato utilizzando la potenziale intensità di cura necessaria per il trattamento e la stabilizzazione del paziente. Questa definizione rivista affronta molte delle carenze della definizione attuale e dovrebbe informare meglio l’assistenza clinica, la ricerca e la pianificazione dei servizi sanitari, ma deve essere validata prospetticamente in studi adeguatamente progettati e alimentati.
Altri test importanti
I relatori hanno esaminato altri 16 test clinici e di laboratorio utilizzati nella diagnosi e nella classificazione della gravità dell’ECOPD. Di questi, molti richiedono qualche commento.
La spirometria di routine o qualsiasi valutazione della funzionalità polmonare non possono essere ottenute in modo affidabile durante un ECOPD poiché i pazienti sono solitamente troppo malati per eseguire una manovra spirometrica adeguata, i cambiamenti rispetto al basale sono spesso piccoli e i risultati prima dell’ECOPD potrebbero non essere disponibili.
I relatori hanno inoltre ritenuto che gli sforzi compiuti per sviluppare dispositivi accurati in grado di aiutare a monitorare la funzione polmonare nel tempo fornirebbero un importante progresso nella nostra capacità di integrare questa variabile nei futuri miglioramenti di questa proposta.
Gli eosinofili nel sangue periferico avrebbero un potenziale utilizzo come guida terapeutica, in particolare per quanto riguarda l’uso sistemico di steroidi, ma i livelli di eosinofili non sono stati utilizzati per la diagnosi ECOPD o per la classificazione della gravità.
La radiografia del torace è utile per differenziare la polmonite (e altre condizioni che possono simulare l’ECOPD come pneumotorace o pleurite) dall’ECOPD e viene spesso eseguita in pazienti trattati in strutture sanitarie, ma questo strumento non è stato utilizzato per definire o classificare la gravità della malattia. un ECOPD.
| In conclusione , incorporando variabili cliniche e di laboratorio misurabili al momento della riacutizzazione, la proposta di Roma per una definizione aggiornata di ECOPD potrebbe aiutare a standardizzare la cura e i risultati sia per i medici che per i ricercatori. |















