| 1. Introduzione |
L’arterite a cellule giganti (GCA), precedentemente nota come malattia di Horton o arterite temporale, è la vasculite più comune che colpisce le persone di età superiore ai 50 anni. La GCA è caratterizzata da un’infiammazione granulomatosa che colpisce le arterie di medio e grosso calibro, causando danni acuti e cronici. Oltre alla chiara associazione con l’età avanzata, sono stati descritti altri fattori, come varianti genetiche nella regione del complesso maggiore di istocompatibilità.
La cefalea di nuova insorgenza, che riflette il coinvolgimento delle arterie temporali e dei loro rami, è la manifestazione tipica della ACG, insieme all’aumento dei reagenti sierici della fase acuta.
In questo scenario, la perdita permanente della vista è la complicanza più temuta. Negli ultimi decenni, il paradigma classico della GCA si è progressivamente evoluto verso un modello più completo che comprende l’infiammazione sia delle arterie craniche (C-GCA) che extracraniche (grandi vasi, GV-GCA).
Questo scenario è ulteriormente complicato dalla forte associazione tra ACG e polimialgia reumatica (PMR), una malattia infiammatoria che colpisce le strutture periarticolari con caratteristiche epidemiologiche simili. Infatti, i casi di PMR refrattaria agli steroidi sono stati descritti come l’unica caratteristica di presentazione della GV-ACG e sono state riscontrate prove di infiammazione subclinica nelle arterie temporali in pazienti con PMR senza evidenza clinica evidente di GCA.
Anche l’algoritmo diagnostico GCA ha fatto notevoli progressi. Sebbene la biopsia dell’arteria temporale (TAB) abbia storicamente rappresentato l’unico strumento, negli ultimi anni la conferma non invasiva della ACG mediante imaging vascolare è diventata più comune.
I glucocorticoidi rappresentano ancora il cardine del trattamento dell’ACG, tuttavia l’inibizione dell’interleuchina (IL-) 6 è diventata un’opzione terapeutica fondamentale dopo la dimostrazione della notevole efficacia del tocilizumab. Si stanno studiando nuovi farmaci promettenti che, si spera, rafforzeranno l’arsenale terapeutico della GCA nei prossimi anni.
L’ obiettivo di questa revisione è quello di evidenziare le conoscenze esistenti sulla diagnosi e sul trattamento della ACG, con un focus specifico sulle innovazioni che hanno segnato gli anni più recenti.
2. Diagnosi
2.1. Caratteristiche cliniche
Lo spettro clinico della GCA è ampio e spazia dai classici sintomi cranici alle manifestazioni costituzionali aspecifiche. È essenziale limitare i ritardi nella diagnosi, poiché la GCA può causare complicanze ischemiche acute e irreversibili.
2.1.1. Sintomi cranici
Il mal di testa persistente di nuova insorgenza è il sintomo di esordio più comune e si verifica in più di due terzi dei pazienti.
Il coinvolgimento delle arterie craniche può anche causare dolorabilità del cuoio capelluto, disfagia e claudicatio della mascella e della lingua.
Nei pazienti con ACG craniale, l’esame obiettivo può rivelare anomalie dell’arteria temporale, tra cui prominenza, dolorabilità e mancanza di polso. Occorre prestare attenzione anche alle arterie occipitale e facciale, poiché anch’esse possono essere ingrossate o dolenti. Tuttavia, un aspetto normale delle arterie temporali non esclude una diagnosi di ACG.
I sintomi visivi sono la manifestazione clinica più temuta della ACG, poiché potrebbero annunciare lo sviluppo di complicanze ischemiche irreversibili. I pazienti possono riferire un difetto parziale improvviso e autolimitante del campo visivo (amaurosi fugax) o diplopia, che è altamente specifico per la ACG. Se non trattati, questi sintomi possono progredire fino alla perdita irreversibile della vista.
Il meccanismo più comune alla base della perdita della vista è la neuropatia ottica arteritica ischemica anteriore (AION), sostenuta dall’occlusione infiammatoria dell’arteria ciliare posteriore, un ramo dell’arteria oftalmica.
2.1.2. Manifestazioni sistemiche e vascolari
Un lieve grado di febbre può essere presente in più della metà dei pazienti con ACG, mentre una temperatura corporea superiore a 39°C non è tipica e dovrebbe orientare verso diagnosi alternative.
Va notato che la GCA è una delle cause più comuni di febbre di origine sconosciuta negli anziani.
Una maggiore prevalenza di sintomi sistemici è stata segnalata nei pazienti con coinvolgimento extracranico. Pertanto, quando prevalgono queste manifestazioni, le arterie extracraniche dovrebbero essere indagate indipendentemente dalla presenza di sintomi cranici.
La vasculite dell’aorta e dei suoi rami può anche causare sintomi vascolari simili a quelli più comunemente riportati dai pazienti con arterite di Takayasu. I più tipici sono l’arteriodinia, un dolore bruciante nell’area di un’arteria infiammata (ad esempio carotidnia), e la claudicatio delle estremità, un dolore ischemico causato dalla stenosi acuta o cronica di un’arteria delle estremità.
2.1.3. Polimialgia reumatica
La PMR è una condizione infiammatoria caratterizzata dall’insorgenza improvvisa di dolore simmetrico e rigidità del collo, delle spalle e dei cingoli dell’anca. La limitazione funzionale è solitamente presente, soprattutto al mattino, e ha un impatto significativo sulle attività quotidiane.
Circa il 50% dei pazienti con ACG mostra contemporaneamente caratteristiche di PMR. Al contrario, fino al 20% dei pazienti con diagnosi di PMR sviluppa GCA. Per evitare ritardi nella diagnosi, è necessario prestare particolare attenzione ai pazienti affetti da PMR che riferiscono sintomi compatibili con la ACG. L’identificazione del coinvolgimento dei grandi vasi in questi casi è essenziale poiché la dose iniziale di glucocorticoidi richiesta per la gestione della ACG è più elevata.
2.2. Caratteristiche del laboratorio
Poiché la GCA è una malattia infiammatoria sistemica, gli esami di laboratorio rappresentano un utile ausilio nella valutazione di nuovi pazienti. L’aumento dei classici reagenti della fase acuta è un elemento chiave che accompagna l’insorgenza della ACG. Al contrario, livelli normali non lo escludono definitivamente, ma dovrebbero far sorgere il sospetto di diagnosi alternative. Negli ultimi anni sono stati identificati nuovi biomarcatori della malattia che potrebbero aiutare nella diagnosi della ACG e nell’individuazione di recidive della malattia.
2.2.1. Biomarcatori classici
I classici marcatori infiammatori sono la proteina C-reattiva (CRP) e la velocità di eritrosedimentazione (VES).
Se eseguiti nel contesto appropriato, livelli elevati di questi biomarcatori hanno un’elevata sensibilità per una diagnosi di ACG, poiché possono essere riscontrati entro limiti normali in meno del 5% dei pazienti.
L’infiammazione sistemica è anche associata ad un aumento dei valori di fibrinogeno plasmatico e della frazione alfa-2 sull’elettroforesi delle proteine sieriche, e anche questi due biomarcatori sono correlati all’attività della malattia.
2.2.2. Nuovi biomarcatori
IL-6 svolge un ruolo di primo piano nella patogenesi della GCA e un aumento dei suoi livelli sierici è stato associato ad un aumento del rischio di future ricadute in uno studio che ha valutato pazienti trattati con tocilizumab. Tuttavia, non esiste alcuna prova definitiva che i livelli di IL-6 siano correlati all’attività della malattia. Inoltre, la sua misurazione è costosa e non disponibile ovunque.
L’osteopontina è una glicoproteina che partecipa a diverse vie infiammatorie ed è altamente espressa nelle biopsie tissutali di pazienti con ACG. I livelli sierici di questo biomarcatore sono significativamente più alti nei pazienti con malattia attiva e non vengono modificati da tocilizumab. Inoltre, la calprotectina sierica è correlata all’attività della malattia nei pazienti con ACG in trattamento con glucocorticoidi e probabilmente mantiene un ruolo predittivo anche durante la terapia con blocco dell’IL-6.
È stato inoltre dimostrato che gli anticorpi contro il peptide di ferritina umana sono presenti in oltre il 90% dei pazienti con ACG attiva, rendendolo un marcatore diagnostico potenzialmente utile. Sebbene tutti questi nuovi biomarcatori sembrino promettenti, sono necessari ulteriori studi per valutare la loro affidabilità e la loro applicazione nella pratica clinica quotidiana.
23. Biopsia dell’arteria temporale
Per decenni, la biopsia arteriosa ha rappresentato l’unico strumento disponibile per confermare la diagnosi di ACG.
L’esecuzione di una biopsia, infatti, permette di ottenere l’evidenza istologica dei processi infiammatori che caratterizzano questa patologia. La procedura viene quasi sempre eseguita nell’arteria temporale superficiale, poiché questo sito è facilmente accessibile e la sua rimozione ha conseguenze minime.
2.3.1. Prestazioni diagnostiche
La TAB ha un’elevata specificità per la diagnosi di ACG (fino al 100%). Tuttavia, la sua sensibilità è molto più bassa. Le cause principali oltre a un risultato BAT falso negativo sono il campionamento inadeguato e la natura segmentata dell’infiammazione nelle lesioni vascolari.
Se il sospetto clinico di ACG è elevato, la terapia steroidea non dovrebbe mai essere ritardata per la BAT. Tuttavia, deve essere ottenuto entro quattro settimane dall’inizio del trattamento, poiché dosi elevate di glucocorticoidi possono portare alla progressiva risoluzione dell’infiltrato infiammatorio vascolare.
2.3.2. Reperti istologici
Nelle arterie affette da ACG si riscontra tipicamente un infiltrato infiammatorio misto transmurale comprendente linfociti, macrofagi e cellule giganti. Un tessuto infiammatorio più spesso che circonda la lamina elastica esterna ed una componente infiammatoria più sottile lungo la lamina elastica interna conferiscono al vaso un caratteristico aspetto ad “anelli concentrici”.
Si sta prendendo in considerazione l’impatto clinico dei diversi modelli di infiltrazione linfocitaria. Sembra che l’infiammazione Th1-dipendente possa rispondere scarsamente ai glucocorticoidi e potrebbe essere associata a un fenotipo più recidivante. Pertanto, l’introduzione precoce di agenti risparmiatori di steroidi potrebbe essere utile quando le cellule Th1 rappresentano la caratteristica istologica predominante.
2.4. immagini
Al giorno d’oggi, le tecniche di imaging sono essenziali nella diagnosi della ACG. Dovrebbero sempre essere interpretati nel contesto dei risultati clinici e di laboratorio per evitare diagnosi errate. Non è invece ancora del tutto chiarito il suo ruolo nel monitoraggio dei pazienti dopo l’inizio della terapia e nella definizione dell’attività della malattia.
2.4.1. Ecografia arteriosa Color Doppler
Il ruolo degli ultrasuoni nella diagnosi dell’ACG è stato dimostrato per la prima volta nel 1997, quando è stata notata la presenza di un caratteristico alone ipoecogeno non comprimibile ( "segno dell’alone" ) attorno alle arterie temporali in un paziente con una nuova malattia. aspetto. Si ritiene che quest’area circonferenziale attorno al lume vascolare rappresenti l’edema murale.
Molto specifica per la ACG è la presenza del segno dell’alone bilaterale delle arterie temporali, così come la sua persistente visibilità durante la compressione da parte della sonda ecografica (“segno della compressione”).
Nell’ultimo decennio, l’ecografia è diventata ampiamente disponibile ed è ora accettata come surrogato diagnostico della BAT, a condizione che venga eseguita da un medico esperto. Le attuali linee guida europee suggeriscono che l’ecografia dovrebbe essere scelta come primo esame diagnostico all’esordio della malattia, per la sua bassa invasività e la rapida disponibilità dei risultati.
Gli ultrasuoni sono stati validati anche allo scopo di monitorare i pazienti e valutare la risposta al trattamento. Un recente studio prospettico ha dimostrato che il segno dell’alone è correlato ai marcatori dell’attività della malattia e alla dose cumulativa di glucocorticoidi. Inoltre, è presente in oltre il 90% delle recidive della malattia.
2.4.2. Tomografia ad emissione di positroni con [18F]-fluorodesossiglucosio
Negli ultimi anni, l’uso della FDG-PET/CT ha acquisito maggiore importanza nella diagnosi della ACG, poiché aiuta a escludere diagnosi alternative e a rilevare la presenza di coinvolgimento dell’arteria extracranica. L’arterite extracranica comprende generalmente un’infiammazione diffusa dell’aorta e dei suoi rami, che spesso sono coinvolti bilateralmente. ( Figura 1a ). Rispetto all’arterite di Takayasu, l’infiammazione delle arterie mesenteriche e renali è eccezionale, mentre sono più frequentemente colpite le arterie ascellari.
Le attuali linee guida suggeriscono di richiedere la FDG-PET/CT nei pazienti con sintomi suggestivi di arterite extracranica . Da notare che i pazienti con GV-ACG possono presentarsi senza coinvolgimento cranico (cioè assenza di sintomi cranici ed ecografia/TAB negativa). In questi casi, gli studi di imaging del corpo intero (cioè FDG-PET/CT, CTA e MRA) sono gli unici test in grado di identificare lesioni vasculitiche.
Sebbene la sensibilità della FDG-PET/CT nel rilevare l’infiammazione delle arterie extracraniche sia elevata entro i primi tre giorni dall’inizio della terapia con glucocorticoidi, diminuisce significativamente nelle settimane successive. Per mantenere il potere diagnostico della FDG-PET/CT, questo studio di imaging dovrebbe essere eseguito subito dopo l’inizio della terapia.
2.4.3. Angiografia con risonanza magnetica e tomografia computerizzata
La CTA è una tecnica diffusa e facilmente disponibile. La vasculite attiva è evidenziata dall’ispessimento della parete e dall’aumento del contrasto murale. Inoltre, la TC può mostrare anomalie morfologiche come stenosi e aneurismi. Tuttavia, la CTA non è raccomandata per studiare le arterie craniche a causa della mancanza di prove a riguardo. Inoltre, è associato a una significativa esposizione alle radiazioni e richiede un mezzo di contrasto potenzialmente nefrotossico.
L’angio-RM è una tecnica non radiativa che consente anche di rilevare l’infiammazione arteriosa e le alterazioni luminali. Come nella CTA, l’enhancement e l’ispessimento della parete con il contrasto con gadolinio sono segni di infiammazione dei vasi ( Figura 1b ). Questo approccio è raccomandato se l’ecografia non è disponibile o non è conclusiva.
L’uso combinato di FDG-PET/CT e MRA o CTA è particolarmente utile in quanto consente di abbinare un’analisi quantitativa dell’infiammazione alla caratterizzazione morfologica dei vasi. La presenza di aumento del contrasto nei vasi metabolicamente attivi corrobora la diagnosi di vasculite ed esclude cause alternative di captazione (p. es., aterosclerosi).
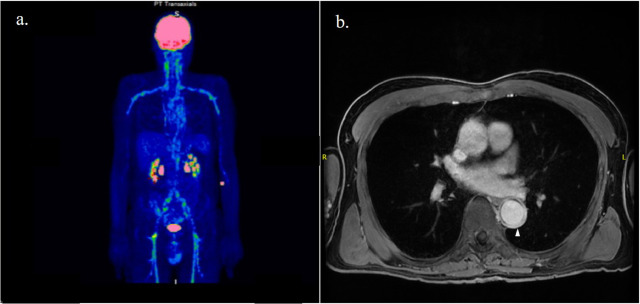
Figura 1. Paziente affetto da arterite a cellule giganti con coinvolgimento dell’aorta e dei suoi rami come evidenziato dall’aumento di contrasto sulla tomografia ad emissione di positroni con [18F]-fluorodeossiglucosio ( a ) e ispessimento della parete (punta della freccia) sulle scansioni angiografiche con risonanza magnetica ( b ).
3. Trattamento
Il trattamento dell’ACG ha tre obiettivi principali: i) smorzare il processo infiammatorio disturbato per evitare complicanze ischemiche acute; ii) prevenire le ricadute della malattia utilizzando la dose efficace più bassa (se presente) di glucocorticoidi; iii) prevenire il danno vascolare a lungo termine (ad esempio aneurisma e stenosi). I glucocorticoidi rimangono il cardine del trattamento dell’ACG. Tuttavia, in casi selezionati, l’aggiunta di farmaci antireumatici modificanti la malattia (DMARD) può essere necessaria per ottenere e mantenere la remissione della malattia.
3.1. Glucocorticoidi
La terapia con glucocorticoidi sistemici ad alte dosi deve essere iniziata quando si sospetta la diagnosi di ACG per prevenire complicanze ischemiche.
Gli studi di imaging e istologici dovrebbero essere ottenuti il prima possibile, ma non dovrebbero mai ritardare la somministrazione di glucocorticoidi.
Le attuali linee guida europee raccomandano una dose iniziale di 1 mg/kg al giorno di equivalente di prednisone, senza superare la dose giornaliera di 60 mg poiché non vi sono prove che suggeriscano ulteriori benefici. Se si verifica una perdita visiva transitoria o permanente, possono essere somministrati impulsi endovenosi di metilprednisolone (da 0,25 a 1 g per un massimo di tre giorni) prima di iniziare la terapia con glucocorticoidi orali per prevenire la progressione del danno o il coinvolgimento controlaterale. Tuttavia, una volta completamente stabilizzata, la perdita della vista è raramente reversibile, indipendentemente dalla via di somministrazione.
Riducendo la dose di glucocorticoidi, il monitoraggio clinico e la misurazione seriale dei reagenti della fase acuta sono essenziali per identificare le recidive della malattia. Se viene diagnosticata una riacutizzazione, i glucocorticoidi devono essere aumentati all’ultima dose efficace o, in caso di manifestazioni ischemiche, alla dose di induzione.
I rischi associati all’uso prolungato di glucocorticoidi a dosi medio-alte sono particolarmente accentuati nei pazienti affetti da ACG a causa dell’età avanzata di questa popolazione. Includono l’osteoporosi e le fratture ossee correlate all’osteoporosi, le comuni infezioni opportunistiche, l’ipertensione, il diabete mellito e il sanguinamento gastrointestinale.
3.2. Agenti risparmiatori di steroidi
In alcuni pazienti selezionati con ACG può essere necessaria l’aggiunta di un agente immunosoppressore non steroideo. Secondo le linee guida europee, i pazienti idonei alla terapia aggiuntiva sono quelli con malattia recalcitrante (cioè si osservano recidive durante la riduzione graduale dei glucocorticoidi) o quando sono presenti fattori di rischio per complicanze correlate agli steroidi.
3.2.1. Farmaci antireumatici modificanti la malattia convenzionali
Nel complesso, gli studi che hanno valutato questo trattamento aggiuntivo ne supportano l’efficacia nel ridurre la dose cumulativa di glucocorticoidi e il tasso di recidiva. Le attuali linee guida europee raccomandano il metotrexato come alternativa al tocilizumab. La dose minima raccomandata è di 15 mg a settimana.
3.2.2. Farmaci antireumatici modificanti la malattia biologica
Tocilizumab è un anticorpo monoclonale che prende di mira il recettore IL-6 ed esercita notevoli effetti antinfiammatori. Può essere somministrato per via sottocutanea (alla dose settimanale di 162 mg) o per via endovenosa (alla dose mensile di 8 mg/kg). Nei pazienti con ACG, l’aggiunta di tocilizumab porta a tassi di remissione più elevati rispetto alla monoterapia con glucocorticoidi, anche quando i glucocorticoidi vengono ridotti gradualmente secondo un regime accelerato (cioè entro sei mesi).
La durata ottimale del trattamento con tocilizumab è attualmente sconosciuta. La brusca interruzione dopo un anno è associata a un tasso di recidiva del 50%. Pertanto, la maggior parte dei pazienti potrebbe meritare un trattamento più lungo, magari a dosi più basse.
4. Recidive e complicazioni a lungo termine
Sebbene la risposta ai glucocorticoidi sia generalmente soddisfacente, l’ACG recidiva durante e dopo la riduzione graduale del trattamento. Le recidive della ACG vanno dall’infiammazione subclinica che può essere rilevata solo con test di laboratorio e imaging a manifestazioni clinicamente evidenti.
Quando viene diagnosticata una recidiva, i glucocorticoidi devono essere aumentati all’ultima dose efficace o, in caso di manifestazioni ischemiche, alla dose di induzione. Si raccomanda anche in questo caso di iniziare i DMARD per prevenire nuovi focolai della malattia e ridurre la dose cumulativa di steroidi.
Oltre al rischio imminente di complicanze vascolari come cecità e ictus, la GCA comprende anche complicazioni a lungo termine come aneurismi e stenosi vascolare. Gli aneurismi aortici possono complicare la storia dei pazienti con ACG fino al 20% dei casi. A differenza degli aneurismi legati all’aterosclerosi, gli aneurismi legati alla GCA sono più comunemente osservati nell’aorta toracica che nel tratto addominale.
5. Conclusioni Negli ultimi decenni, lo spettro della GCA si è ampliato oltre la semplice infiammazione dei vasi cranici. Questa condizione può ora essere considerata una sindrome vasculitica multiforme. Sebbene la GCA possa causare una significativa morbilità a causa del danno vascolare acuto e cronico, l’approccio diagnostico a questa malattia è notevolmente migliorato negli ultimi anni. L’introduzione di tocilizumab nell’algoritmo terapeutico ha aumentato considerevolmente le possibilità di controllare l’attività della malattia nella maggior parte dei pazienti. Tuttavia, alcune domande sulla patogenesi e sulla storia naturale della GCA rimangono irrisolte e richiedono ulteriori indagini. Questi aspetti, una volta chiariti, miglioreranno la gestione clinica e la prognosi dei pazienti affetti da questa malattia. Ogni nuovo paziente con sospetta ACG di nuova insorgenza deve essere sottoposto a una stadiazione adeguata, utilizzando le diverse tecniche di imaging disponibili, per stabilire l’estensione della malattia (ad es. GCA craniale vs extracranica +/- PMR). Sulla base dei dati esistenti, si ritiene che la gestione dei pazienti con ACG cranica ed extracranica debba seguire percorsi diversi. Il primo gruppo può meritare dosi iniziali più elevate di glucocorticoidi e può trarre beneficio dalla monoterapia con glucocorticoidi, almeno nelle fasi iniziali. Al contrario, nei pazienti con malattia extracranica, l’introduzione di un agente risparmiatore di steroidi dovrebbe essere ricercata fin dall’inizio per ridurre la frequenza delle riacutizzazioni. Tocilizumab dovrebbe sempre essere l’agente antireumatico preferito, se non controindicato, poiché il suo utilizzo è basato su dati più robusti. Tuttavia, si fa molto affidamento sui nuovi farmaci attualmente in fase di studio, come secukinumab e gli inibitori JAK. |