| 1. Einleitung |
Die Riesenzellarteriitis (GCA), früher bekannt als Morbus Horton oder Arteriitis temporalis, ist die häufigste Vaskulitis bei Menschen über 50 Jahren. GCA ist durch eine granulomatöse Entzündung gekennzeichnet, die mittelgroße und große Arterien betrifft und akute und chronische Schäden verursacht. Neben dem eindeutigen Zusammenhang mit dem fortgeschrittenen Alter wurden weitere Faktoren beschrieben, beispielsweise genetische Varianten in der Region des Haupthistokompatibilitätskomplexes.
Neu auftretende Kopfschmerzen, die eine Beteiligung der Schläfenarterien und ihrer Äste widerspiegeln, sind zusammen mit einem Anstieg der Akute-Phase-Reaktanten im Serum die prototypische Manifestation einer GCA.
In diesem Szenario ist der dauerhafte Verlust der Sehkraft die am meisten gefürchtete Komplikation. In den letzten Jahrzehnten hat sich das klassische GCA-Paradigma schrittweise zu einem umfassenderen Modell weiterentwickelt, das Entzündungen sowohl der kranialen (C-GCA) als auch der extrakraniellen Arterien (große Gefäße, GV-GCA) umfasst.
Dieses Szenario wird durch den starken Zusammenhang zwischen GCA und Polymyalgia rheumatica (PMR) noch komplizierter, einer entzündlichen Erkrankung, die periartikuläre Strukturen mit ähnlichen epidemiologischen Merkmalen betrifft. Tatsächlich wurden Fälle von steroidrefraktärer PMR als einziges Merkmal von GV-ACG beschrieben, und bei Patienten mit PMR ohne offensichtliche klinische Anzeichen einer GCA wurden Hinweise auf eine subklinische Entzündung in den Schläfenarterien gefunden.
Auch der GCA-Diagnosealgorithmus hat erhebliche Fortschritte gemacht. Obwohl die Schläfenarterienbiopsie (TAB) in der Vergangenheit das einzige Instrument darstellte, ist in den letzten Jahren die nicht-invasive Bestätigung der GCA mittels Gefäßbildgebung häufiger geworden.
Glukokortikoide stellen immer noch die Hauptstütze der GCA-Behandlung dar, jedoch ist die Hemmung von Interleukin (IL-) 6 nach dem Nachweis der bemerkenswerten Wirksamkeit von Tocilizumab zu einer grundlegenden Therapieoption geworden. Es werden vielversprechende neue Medikamente untersucht, die hoffentlich das therapeutische Arsenal der GCA in den kommenden Jahren stärken werden.
Das Ziel dieser Übersicht besteht darin, das vorhandene Wissen über die Diagnose und Behandlung von GCA hervorzuheben, mit besonderem Schwerpunkt auf den Innovationen, die in den letzten Jahren stattgefunden haben.
2. Diagnose
2.1. Klinische Merkmale
Das klinische Spektrum der GCA ist breit und reicht von klassischen kranialen Symptomen bis hin zu unspezifischen konstitutionellen Manifestationen. Es ist wichtig, Verzögerungen bei der Diagnose zu begrenzen, da GCA akute und irreversible ischämische Komplikationen verursachen kann.
2.1.1. Schädelsymptome
Neu auftretende, anhaltende Kopfschmerzen sind das häufigste Symptom und treten bei mehr als zwei Dritteln der Patienten auf.
Eine Beteiligung der Schädelarterien kann auch zu Empfindlichkeit der Kopfhaut, Dysphagie und Claudicatio des Kiefers und der Zunge führen.
Bei Patienten mit kranialer GCA kann die körperliche Untersuchung Anomalien der Schläfenarterie aufdecken, einschließlich Hervortreten, Druckempfindlichkeit und fehlendem Puls. Auch auf die Hinterhaupts- und Gesichtsarterien sollte geachtet werden, da diese ebenfalls vergrößert oder schmerzempfindlich sein können. Ein normales Erscheinungsbild der Schläfenarterien schließt jedoch die Diagnose einer GCA nicht aus.
Visuelle Symptome sind die am meisten gefürchtete klinische Manifestation der GCA, da sie die Entwicklung irreversibler ischämischer Komplikationen ankündigen könnten. Patienten können über einen abrupten, selbstlimitierenden partiellen Gesichtsfelddefekt (Amaurosis fugax) oder Diplopie berichten, was sehr spezifisch für GCA ist. Unbehandelt können diese Symptome zu einem irreversiblen Sehverlust führen.
Der häufigste Mechanismus, der dem Sehverlust zugrunde liegt, ist die arteritische anteriore ischämische Optikusneuropathie (AION), die durch einen entzündlichen Verschluss der hinteren Ziliararterie, einem Zweig der Augenarterie, verursacht wird.
2.1.2. Systemische und vaskuläre Manifestationen
Bei mehr als der Hälfte der GCA-Patienten kann leichtes Fieber vorliegen, während eine Körpertemperatur über 39 °C nicht typisch ist und zu alternativen Diagnosen führen sollte.
Es ist zu beachten, dass GCA eine der häufigsten Ursachen für Fieber unbekannter Ursache bei älteren Menschen ist.
Bei Patienten mit extrakranieller Beteiligung wurde über eine höhere Prävalenz systemischer Symptome berichtet. Wenn diese Manifestationen vorherrschen, sollten daher die extrakraniellen Arterien unabhängig vom Vorliegen kranialer Symptome untersucht werden.
Eine Vaskulitis der Aorta und ihrer Äste kann auch Gefäßsymptome verursachen, die denen ähneln, über die am häufigsten bei Patienten mit Takayasu-Arteritis berichtet wird. Am typischsten sind Arteriodynie, ein brennender Schmerz über dem Bereich einer entzündeten Arterie (z. B. Karotisnie), und Extremitäten-Claudicatio, ein ischämischer Schmerz, der durch eine akute oder chronische Stenose einer Arterie in den Extremitäten verursacht wird.
2.1.3. Polymyalgia rheumatica
PMR ist eine entzündliche Erkrankung, die durch das plötzliche Einsetzen symmetrischer Schmerzen und Steifheit im Nacken-, Schulter- und Hüftgürtel gekennzeichnet ist. Vor allem morgens kommt es in der Regel zu funktionellen Einschränkungen, die die täglichen Aktivitäten erheblich beeinträchtigen.
Ungefähr 50 % der GCA-Patienten weisen gleichzeitig Merkmale einer PMR auf. Im Gegensatz dazu entwickeln bis zu 20 % der mit PMR diagnostizierten Patienten eine GCA. Um Verzögerungen bei der Diagnose zu vermeiden, sollte besonderes Augenmerk auf Patienten mit PMR gelegt werden, die über Symptome berichten, die mit einer GCA vereinbar sind. In diesen Fällen ist die Identifizierung einer Beteiligung großer Gefäße unerlässlich, da die für die Behandlung von GCA erforderliche Anfangsdosis an Glukokortikoiden höher ist.
2.2. Laborfunktionen
Da es sich bei GCA um eine systemische entzündliche Erkrankung handelt, stellen Labortests eine nützliche Hilfe bei der Beurteilung neuer Patienten dar. Der Anstieg klassischer Akute-Phase-Reaktanten ist ein Schlüsselelement, das mit dem Auftreten von GCA einhergeht. Im Gegenteil, normale Werte schließen dies nicht endgültig aus, sollten aber den Verdacht auf alternative Diagnosen wecken. In den letzten Jahren wurden neue Krankheitsbiomarker identifiziert, die möglicherweise bei der Diagnose von GCA und der Erkennung von Krankheitsrückfällen hilfreich sind.
2.2.1. Klassische Biomarker
Klassische Entzündungsmarker sind das C-reaktive Protein (CRP) und die Blutsenkungsgeschwindigkeit (ESR).
Bei entsprechender Durchführung weisen erhöhte Werte dieser Biomarker eine hohe Sensitivität für die Diagnose einer GCA auf, da sie bei weniger als 5 % der Patienten innerhalb normaler Grenzen gefunden werden können.
Eine systemische Entzündung ist auch mit einem Anstieg der Plasma-Fibrinogenwerte und der Alpha-2-Fraktion bei der Serumproteinelektrophorese verbunden, und diese beiden Biomarker korrelieren auch mit der Krankheitsaktivität.
2.2.2. Neue Biomarker
IL-6 spielt eine herausragende Rolle bei der Pathogenese von GCA und ein Anstieg seiner Serumspiegel wurde in einer Studie, in der mit Tocilizumab behandelte Patienten untersucht wurden, mit einem erhöhten Risiko künftiger Rückfälle in Verbindung gebracht. Es gibt jedoch keinen eindeutigen Beweis dafür, dass der IL-6-Spiegel mit der Krankheitsaktivität korreliert. Darüber hinaus ist seine Messung teuer und nicht überall verfügbar.
Osteopontin ist ein Glykoprotein, das an mehreren Entzündungswegen beteiligt ist und in Gewebebiopsien von Patienten mit GCA stark exprimiert wird. Die Serumspiegel dieses Biomarkers sind bei Patienten mit aktiver Erkrankung deutlich höher und werden durch Tocilizumab nicht verändert. Darüber hinaus korreliert Serum-Calprotectin mit der Krankheitsaktivität bei GCA-Patienten unter Glukokortikoid-Behandlung und behält möglicherweise auch während der IL-6-Blockade-Therapie eine solche prädiktive Rolle bei.
Es wurde auch gezeigt, dass bei mehr als 90 % der Patienten mit aktiver GCA Antikörper gegen menschliches Ferritinpeptid vorhanden sind, was es zu einem potenziell nützlichen diagnostischen Marker macht. Obwohl alle diese neuen Biomarker vielversprechend erscheinen, sind weitere Studien erforderlich, um ihre Zuverlässigkeit und ihre Anwendung in der täglichen klinischen Praxis zu bewerten.
23. Biopsie der Schläfenarterie
Jahrzehntelang war die arterielle Biopsie das einzige verfügbare Instrument zur Bestätigung der GCA-Diagnose.
Tatsächlich ermöglicht uns die Durchführung einer Biopsie, histologische Beweise für die entzündlichen Prozesse zu erhalten, die diese Pathologie charakterisieren. Der Eingriff wird fast immer an der oberflächlichen Schläfenarterie durchgeführt, da diese Stelle leicht zugänglich ist und ihre Entfernung nur minimale Folgen hat.
2.3.1. Diagnostische Leistung
TAB weist eine hohe Spezifität für die Diagnose von GCA auf (bis zu 100 %). Allerdings ist seine Empfindlichkeit deutlich geringer. Die Hauptursachen für ein falsch negatives BAT-Ergebnis sind eine schlechte Probenentnahme und die segmentierte Natur der Entzündung in Gefäßläsionen.
Wenn der klinische Verdacht auf GCA hoch ist, sollte die Steroidtherapie wegen BAT niemals verzögert werden. Es sollte jedoch innerhalb von vier Wochen nach Beginn der Behandlung erfolgen, da hohe Dosen von Glukokortikoiden zu einer fortschreitenden Auflösung des vaskulären Entzündungsinfiltrats führen können.
2.3.2. Histologische Befunde
In von GCA betroffenen Arterien findet sich typischerweise ein transmurales gemischtes entzündliches Infiltrat aus Lymphozyten, Makrophagen und Riesenzellen. Ein dickeres entzündliches Gewebe, das die äußere elastische Lamina umgibt, und eine dünnere entzündliche Komponente entlang der inneren elastischen Lamina verleihen dem Gefäß das charakteristische Aussehen „konzentrischer Ringe“.
Die klinischen Auswirkungen verschiedener Muster der Lymphozyteninfiltration werden berücksichtigt. Es scheint, dass Th1-abhängige Entzündungen möglicherweise schlecht auf Glukokortikoide ansprechen und mit einem eher rezidivierenden Phänotyp verbunden sein könnten. Daher könnte die frühzeitige Einführung steroidsparender Wirkstoffe von Vorteil sein, wenn Th1-Zellen das vorherrschende histologische Merkmal darstellen.
2.4. Bilder
Heutzutage sind bildgebende Verfahren für die Diagnose einer GCA unerlässlich. Sie sollten immer im Kontext der klinischen und Laborbefunde interpretiert werden, um Fehldiagnosen zu vermeiden. Andererseits ist seine Rolle bei der Überwachung von Patienten nach Beginn der Therapie und bei der Definition der Krankheitsaktivität noch nicht vollständig geklärt.
2.4.1. Farbdoppler-Arterienultraschall
Die Rolle des Ultraschalls bei der Diagnose von GCA wurde erstmals 1997 nachgewiesen, als bei einem Patienten mit neuer Erkrankung das Vorhandensein eines charakteristischen nicht komprimierbaren echoarmen Halos ( „Halo-Zeichen“ ) um die Schläfenarterien festgestellt wurde. Aussehen. Es wird angenommen, dass dieser Umfangsbereich um das Gefäßlumen ein Wandödem darstellt.
Das Vorhandensein des bilateralen Halo-Zeichens der Schläfenarterien ist sehr spezifisch für eine GCA, ebenso wie dessen anhaltende Sichtbarkeit während der Kompression durch die Ultraschallsonde („Kompressionszeichen“).
Im letzten Jahrzehnt ist Ultraschall weit verbreitet und wird heute als diagnostischer Ersatz für BAT akzeptiert, sofern er von einem erfahrenen Kliniker durchgeführt wird. Aufgrund seiner geringen Invasivität und der schnellen Verfügbarkeit von Ergebnissen empfehlen aktuelle europäische Leitlinien, Ultraschall als ersten diagnostischen Test zu Beginn der Krankheit zu wählen.
Ultraschall wurde auch für die Überwachung von Patienten und die Beurteilung des Ansprechens auf die Behandlung validiert. Eine aktuelle prospektive Studie hat gezeigt, dass das Halo-Zeichen mit Markern der Krankheitsaktivität und der kumulativen Glukokortikoiddosis korreliert. Darüber hinaus liegt es in über 90 % der Fälle bei Rückfällen der Erkrankung vor.
2.4.2. [18F]-Fluordesoxyglucose-Positronenemissionstomographie
In den letzten Jahren hat der Einsatz der FDG-PET/CT bei der Diagnose von GCA an Bedeutung gewonnen, da sie hilft, alternative Diagnosen auszuschließen und das Vorliegen einer extrakraniellen Arterienbeteiligung festzustellen. Bei der extrakraniellen Arteriitis handelt es sich im Allgemeinen um eine diffuse Entzündung der Aorta und ihrer Äste, die häufig beidseitig befallen ist. ( Abbildung 1a ). Im Vergleich zur Takayasu-Arteriitis ist eine Entzündung der Mesenterial- und Nierenarterien eine Ausnahme, wobei die Achselarterien am häufigsten betroffen sind.
Aktuelle Richtlinien schlagen vor, bei Patienten mit Symptomen, die auf eine extrakranielle Arteriitis hinweisen, eine FDG-PET/CT anzufordern . Bemerkenswert ist, dass Patienten mit GV-ACG möglicherweise ohne kraniale Beteiligung auftreten (d. h. ohne kraniale Symptome und negativer US/TAB). In diesen Fällen sind Ganzkörper-Bildgebungsstudien (d. h. FDG-PET/CT, CTA und MRA) die einzigen Tests, die vaskulitische Läsionen identifizieren können.
Obwohl die Sensitivität der FDG-PET/CT beim Nachweis von Entzündungen extrakranieller Arterien innerhalb der ersten drei Tage nach Beginn der Glukokortikoidtherapie hoch ist, nimmt sie in den folgenden Wochen deutlich ab. Um die diagnostische Aussagekraft der FDG-PET/CT zu erhalten, sollte diese bildgebende Untersuchung bald nach Beginn der Therapie durchgeführt werden.
2.4.3. Magnetresonanzangiographie und Computertomographie
CTA ist eine weit verbreitete und leicht verfügbare Technik. Eine aktive Vaskulitis äußert sich in einer Wandverdickung und einer verstärkten Wandkontrastverstärkung. Darüber hinaus kann die CTA morphologische Anomalien wie Stenosen und Aneurysmen aufweisen. Allerdings wird die CTA nicht zur Untersuchung von Schädelarterien empfohlen, da diesbezüglich keine Beweise vorliegen. Darüber hinaus ist sie mit einer erheblichen Strahlenbelastung verbunden und erfordert ein potenziell nephrotoxisches Kontrastmittel.
MRA ist eine strahlungsfreie Technik, die auch die Erkennung arterieller Entzündungen und Lumenveränderungen ermöglicht. Wie bei der CTA sind Enhancement und Wandverdickung mit Gadolinium-Kontrast Anzeichen einer Gefäßentzündung ( Abbildung 1b ). Dieser Ansatz wird empfohlen, wenn Ultraschall nicht verfügbar oder nicht aussagekräftig ist.
Der kombinierte Einsatz von FDG-PET/CT und MRA bzw. CTA ist besonders sinnvoll, da hierdurch eine quantitative Analyse der Entzündung mit der morphologischen Charakterisierung der Gefäße kombiniert werden kann. Das Vorhandensein einer Kontrastmittelverstärkung in stoffwechselaktiven Gefäßen bestätigt die Diagnose einer Vaskulitis und schließt alternative Ursachen der Aufnahme (z. B. Arteriosklerose) aus.
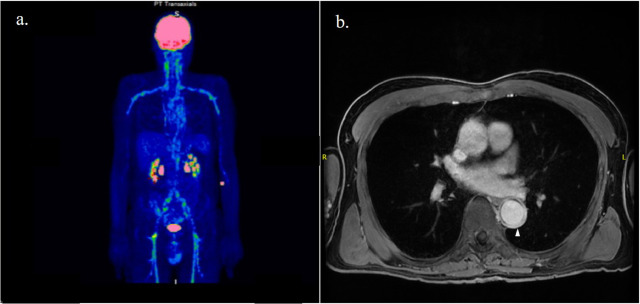
Abbildung 1. Patient mit Riesenzellarteriitis mit Beteiligung der Aorta und ihrer Äste, wie durch Kontrastverstärkung bei der Positronenemissionstomographie mit [18F]-Fluordesoxyglucose ( a ) und Wandverdickung (Pfeilspitze) bei Magnetresonanzangiographie-Scans ( b) zu erkennen ist ).
3. Behandlung
Die Behandlung von GCA hat drei Hauptziele: i) den gestörten Entzündungsprozess zu dämpfen, um akute ischämische Komplikationen zu vermeiden; ii) Krankheitsrückfälle verhindern, indem die niedrigste wirksame Dosis (falls vorhanden) von Glukokortikoiden verwendet wird; iii) langfristige Gefäßschäden (z. B. Aneurysma und Stenose) verhindern. Glukokortikoide bleiben die Hauptstütze der GCA-Behandlung. In ausgewählten Fällen kann jedoch die Zugabe von krankheitsmodifizierenden Antirheumatika (DMARDs) erforderlich sein, um eine Remission der Krankheit zu erreichen und aufrechtzuerhalten.
3.1. Glukokortikoide
Sobald der Verdacht einer GCA besteht, sollte mit der Gabe hochdosierter systemischer Glukokortikoide begonnen werden, um ischämischen Komplikationen vorzubeugen.
Bildgebende und histologische Untersuchungen sollten so schnell wie möglich durchgeführt werden, dürfen jedoch niemals die Verabreichung von Glukokortikoiden verzögern.
Aktuelle europäische Leitlinien empfehlen eine Anfangsdosis von 1 mg/kg Prednisonäquivalent pro Tag, wobei eine Tagesdosis von 60 mg nicht überschritten werden darf, da keine Hinweise auf einen zusätzlichen Nutzen vorliegen. Bei vorübergehendem oder dauerhaftem Sehverlust können vor Beginn der oralen Glukokortikoidgabe intravenöse Methylprednisolon-Impulse (0,25 bis 1 g für bis zu drei Tage) verabreicht werden, um ein Fortschreiten der Schädigung oder eine kontralaterale Beteiligung zu verhindern. Sobald der Sehverlust jedoch vollständig etabliert ist, ist er selten reversibel, unabhängig vom Verabreichungsweg.
Neben der Reduzierung der Glukokortikoiddosis sind die klinische Überwachung und die serielle Messung der Akute-Phase-Reaktanten für die Erkennung von Krankheitsrückfällen unerlässlich. Wenn ein Schub diagnostiziert wird, sollten die Glukokortikoide auf die letzte wirksame Dosis oder bei ischämischen Manifestationen auf die Induktionsdosis erhöht werden.
Die mit der längeren Anwendung von Glukokortikoiden in mäßig hohen Dosen verbundenen Risiken sind aufgrund des fortgeschrittenen Alters dieser Patientengruppe bei Patienten mit GCA besonders ausgeprägt. Dazu gehören Osteoporose und osteoporosebedingte Knochenbrüche, häufige opportunistische Infektionen, Bluthochdruck, Diabetes mellitus und Magen-Darm-Blutungen.
3.2. Steroidsparende Wirkstoffe
Bei einigen ausgewählten Patienten mit GCA kann die Zugabe eines nichtsteroidalen Immunsuppressivums erforderlich sein. Gemäß den europäischen Leitlinien kommen Patienten für eine Zusatztherapie in Frage, wenn sie an einer widerspenstigen Erkrankung leiden (d. h. es werden Rückfälle beobachtet, wenn die Glukokortikoid-Therapie ausschleichend verabreicht wird) oder wenn Risikofaktoren für steroidbedingte Komplikationen vorliegen.
3.2.1. Konventionelle krankheitsmodifizierende Antirheumatika
Insgesamt belegen Studien, in denen diese Zusatzbehandlung untersucht wurde, ihre Wirksamkeit bei der Reduzierung der kumulativen Glukokortikoiddosis und der Rückfallrate. Aktuelle europäische Leitlinien empfehlen Methotrexat als Alternative zu Tocilizumab. Die empfohlene Mindestdosis beträgt 15 mg pro Woche.
3.2.2. Biologische krankheitsmodifizierende Antirheumatika
Tocilizumab ist ein monoklonaler Antikörper, der auf den IL-6-Rezeptor abzielt und eine bemerkenswerte entzündungshemmende Wirkung hat. Es kann subkutan (bei einer wöchentlichen Dosis von 162 mg) oder intravenös (bei einer monatlichen Dosis von 8 mg/kg) verabreicht werden. Bei Patienten mit GCA führt die Zugabe von Tocilizumab zu höheren Remissionsraten als eine Glukokortikoid-Monotherapie, selbst wenn die Glukokortikoide nach einem beschleunigten Schema (d. h. innerhalb von sechs Monaten) ausgeschlichen werden.
Die optimale Dauer der Behandlung mit Tocilizumab ist derzeit nicht bekannt. Ein abrupter Abbruch nach einem Jahr ist mit einer Rückfallrate von 50 % verbunden. Daher verdienen die meisten Patienten möglicherweise eine längere Behandlung, möglicherweise mit niedrigeren Dosen.
4. Rückfälle und Langzeitkomplikationen
Obwohl das Ansprechen auf Glukokortikoide in der Regel zufriedenstellend ist, kommt es während und nach dem Ausschleichen der Behandlung zu Rückfällen bei GCA. GCA-Rezidive reichen von subklinischen Entzündungen, die nur durch Labortests und Bildgebung erkannt werden können, bis hin zu klinisch offensichtlichen Manifestationen.
Wenn ein Rückfall diagnostiziert wird, sollten die Glukokortikoide auf die letzte wirksame Dosis oder bei ischämischen Manifestationen auf die Induktionsdosis erhöht werden. Es wird auch empfohlen, in diesem Fall mit DMARDs zu beginnen, um neue Krankheitsausbrüche zu verhindern und die kumulative Steroiddosis zu reduzieren.
Neben dem unmittelbaren Risiko vaskulärer Komplikationen wie Blindheit und Schlaganfall umfasst die GCA auch langfristige Komplikationen wie Aneurysmen und Gefäßstenosen. Aortenaneurysmen können in bis zu 20 % der Fälle die Vorgeschichte von Patienten mit GCA komplizieren. Im Gegensatz zu Atherosklerose-bedingten Aneurysmen treten GCA-bedingte Aneurysmen häufiger in der Brustaorta als im Bauchtrakt auf.
5. Schlussfolgerungen In den letzten Jahrzehnten hat sich das Spektrum der GCA über die bloße Entzündung der Schädelgefäße hinaus erweitert. Dieser Zustand kann heute als vielschichtiges vaskulitisches Syndrom betrachtet werden. Obwohl GCA aufgrund akuter und chronischer Gefäßschäden zu erheblicher Morbidität führen kann, hat sich der diagnostische Ansatz für diese Krankheit in den letzten Jahren deutlich verbessert. Die Einführung von Tocilizumab in den Therapiealgorithmus erhöhte die Chancen, die Krankheitsaktivität bei der Mehrzahl der Patienten zu kontrollieren, erheblich. Einige Fragen zur Pathogenese und zum natürlichen Verlauf der GCA sind jedoch noch ungeklärt und bedürfen weiterer Untersuchungen. Sobald diese Aspekte geklärt sind, werden sie das klinische Management und die Prognose von Patienten, die von dieser Krankheit betroffen sind, verbessern. Jeder neue Patient mit Verdacht auf neu aufgetretene GCA sollte sich einer geeigneten Stadieneinstufung unter Verwendung der verschiedenen verfügbaren bildgebenden Verfahren unterziehen, um das Ausmaß der Erkrankung festzustellen (z. B. kraniale vs. extrakranielle GCA +/- PMR). Basierend auf den vorhandenen Daten wird davon ausgegangen, dass die Behandlung von Patienten mit kranialer und extrakranieller GCA unterschiedliche Wege einschlagen sollte. Die erste Gruppe verdient möglicherweise höhere Anfangsdosen von Glukokortikoiden und kann zumindest in den frühen Stadien von einer Glukokortikoid-Monotherapie profitieren. Im Gegenteil, bei Patienten mit extrakraniellen Erkrankungen sollte von Anfang an die Einführung eines steroidsparenden Mittels angestrebt werden, um die Häufigkeit von Schüben zu reduzieren. Tocilizumab sollte immer das bevorzugte Antirheumatikum sein, sofern keine Kontraindikation besteht, da seine Anwendung auf den belastbarsten Daten basiert. Es besteht jedoch eine große Abhängigkeit von neuen Medikamenten, die derzeit untersucht werden, wie etwa Secukinumab und JAK-Inhibitoren. |