| 1. Introduction |
L’artérite à cellules géantes (ACG), anciennement connue sous le nom de maladie de Horton ou artérite temporale, est la vascularite la plus courante chez les personnes de plus de 50 ans. La GCA se caractérise par une inflammation granulomateuse qui affecte les artères de moyen et gros calibre, provoquant des lésions aiguës et chroniques. Outre l’association évidente avec l’âge avancé, d’autres facteurs ont été décrits, tels que des variantes génétiques dans la région du complexe majeur d’histocompatibilité.
Une nouvelle céphalée d’apparition, reflétant l’implication des artères temporales et de leurs branches, est la manifestation prototypique de la GCA, avec une augmentation des réactifs sériques en phase aiguë.
Dans ce scénario, la perte permanente de la vision est la complication la plus redoutée. Au cours des dernières décennies, le paradigme classique de la GCA a progressivement évolué vers un modèle plus complet englobant l’inflammation des artères crâniennes (C-GCA) et extracrâniennes (gros vaisseaux, GV-GCA).
Ce scénario est encore compliqué par la forte association entre la GCA et la polymyalgie rhumatismale (PMR), un trouble inflammatoire affectant les structures périarticulaires présentant des caractéristiques épidémiologiques similaires. En fait, des cas de PMR réfractaire aux stéroïdes ont été décrits comme la seule caractéristique de GV-ACG, et des signes d’inflammation subclinique dans les artères temporales ont été trouvés chez des patients atteints de PMR sans signe clinique manifeste de GCA.
L’algorithme de diagnostic GCA a également progressé de manière significative. Bien que la biopsie de l’artère temporale (TAB) ait historiquement représenté le seul outil, ces dernières années, la confirmation non invasive de la GCA au moyen de l’imagerie vasculaire est devenue plus courante.
Les glucocorticoïdes représentent toujours le pilier du traitement de la GCA, cependant l’inhibition de l’interleukine (IL-) 6 est devenue une option thérapeutique fondamentale après la démonstration de l’efficacité notable du tocilizumab. De nouveaux médicaments prometteurs sont à l’étude et pourraient, espérons-le, renforcer l’arsenal thérapeutique du GCA dans les années à venir.
L’ objectif de cette revue est de mettre en évidence les connaissances existantes sur le diagnostic et le traitement de l’ACG, avec un accent particulier sur les innovations qui ont marqué les années les plus récentes.
2. Diagnostic
2.1. Caractéristiques cliniques
Le spectre clinique de l’ACG est large et s’étend des symptômes crâniens classiques aux manifestations constitutionnelles non spécifiques. Il est essentiel de limiter les délais de diagnostic, car l’ACG peut entraîner des complications ischémiques aiguës et irréversibles.
2.1.1. Symptômes crâniens
Les céphalées d’apparition récente et persistantes sont le symptôme le plus courant, survenant chez plus des deux tiers des patients.
L’atteinte des artères crâniennes peut également provoquer une sensibilité du cuir chevelu, une dysphagie et une claudication de la mâchoire et de la langue.
Chez les patients atteints de GCA crânienne, l’examen physique peut révéler des anomalies de l’artère temporale, notamment une proéminence, une sensibilité et un manque de pouls. Il convient également de prêter attention aux artères occipitales et faciales, car elles peuvent également être hypertrophiées ou sensibles. Cependant, un aspect normal des artères temporales n’exclut pas un diagnostic de GCA.
Les symptômes visuels sont la manifestation clinique la plus redoutée de l’ACG, car ils pourraient annoncer le développement de complications ischémiques irréversibles. Les patients peuvent signaler un défaut partiel brutal et spontanément résolutif du champ de vision (amaurose fugax) ou une diplopie, très spécifique de l’ACG. S’ils ne sont pas traités, ces symptômes peuvent évoluer vers une perte de vision irréversible.
Le mécanisme le plus courant à l’origine de la perte de vision est la neuropathie optique ischémique antérieure artéritique (NOIA), soutenue par une occlusion inflammatoire de l’artère ciliaire postérieure, une branche de l’artère ophtalmique.
2.1.2. Manifestations systémiques et vasculaires
Une fièvre légère peut être présente chez plus de la moitié des patients atteints d’ACG, tandis qu’une température corporelle supérieure à 39 °C n’est pas typique et devrait orienter vers d’autres diagnostics.
Il convient de noter que la GCA est l’une des causes les plus fréquentes de fièvre d’origine inconnue chez les personnes âgées.
Une prévalence plus élevée de symptômes systémiques a été rapportée chez les patients présentant une atteinte extracrânienne. Par conséquent, lorsque ces manifestations prédominent, les artères extracrâniennes doivent être explorées indépendamment de la présence de symptômes crâniens.
La vascularite de l’aorte et de ses branches peut également provoquer des symptômes vasculaires qui ressemblent à ceux les plus fréquemment rapportés par les patients atteints d’artérite de Takayasu. Les plus typiques sont l’artériodynie, une douleur brûlante au niveau d’une artère enflammée (par exemple, carotidnie), et la claudication des extrémités, une douleur ischémique provoquée par une sténose aiguë ou chronique d’une artère des extrémités.
2.1.3. Pseudopolyarthrite rhizomélique
La PMR est une affection inflammatoire caractérisée par l’apparition brutale d’une douleur et d’une raideur symétriques au niveau du cou, des ceintures des épaules et des hanches. Une limitation fonctionnelle est généralement présente, surtout le matin, et impacte considérablement les activités quotidiennes.
Environ 50 % des patients GCA présentent simultanément des caractéristiques de PMR. En revanche, jusqu’à 20 % des patients diagnostiqués avec une PMR développent une GCA. Pour éviter les retards de diagnostic, une attention particulière doit être accordée aux patients atteints de PMR qui signalent des symptômes compatibles avec la GCA. L’identification de l’atteinte des gros vaisseaux dans ces cas est essentielle puisque la dose initiale de glucocorticoïdes requise pour la prise en charge de la GCA est plus élevée.
2.2. Caractéristiques du laboratoire
La GCA étant une maladie inflammatoire systémique, les tests de laboratoire représentent une aide utile dans l’évaluation de nouveaux patients. L’augmentation des réactifs classiques de la phase aiguë est un élément clé qui accompagne l’apparition de la GCA. Au contraire, des taux normaux ne l’excluent pas définitivement, mais doivent faire suspecter des diagnostics alternatifs. Ces dernières années, de nouveaux biomarqueurs de maladies ont été identifiés, susceptibles de faciliter le diagnostic de la GCA et la détection des rechutes de la maladie.
2.2.1. Biomarqueurs classiques
Les marqueurs inflammatoires classiques sont la protéine C-réactive (CRP) et la vitesse de sédimentation des érythrocytes (ESR).
S’ils sont réalisés dans le contexte approprié, des niveaux élevés de ces biomarqueurs ont une sensibilité élevée pour un diagnostic de GCA, car ils peuvent être trouvés dans les limites normales chez moins de 5 % des patients.
L’inflammation systémique est également associée à une augmentation des valeurs plasmatiques de fibrinogène et de la fraction alpha-2 à l’électrophorèse des protéines sériques, et ces deux biomarqueurs sont également en corrélation avec l’activité de la maladie.
2.2.2. Nouveaux biomarqueurs
L’IL-6 joue un rôle de premier plan dans la pathogenèse de la GCA et une augmentation de ses taux sériques a été associée à un risque accru de rechutes futures dans une étude évaluant des patients traités par tocilizumab. Cependant, il n’existe aucune preuve définitive d’une corrélation entre les niveaux d’IL-6 et l’activité de la maladie. De plus, sa mesure est coûteuse et n’est pas disponible partout.
L’ostéopontine est une glycoprotéine qui participe à plusieurs voies inflammatoires et est fortement exprimée dans les biopsies tissulaires de patients atteints de GCA. Les taux sériques de ce biomarqueur sont significativement plus élevés chez les patients atteints d’une maladie active et ne sont pas modifiés par le tocilizumab. De plus, la calprotectine sérique est en corrélation avec l’activité de la maladie chez les patients GCA sous traitement aux glucocorticoïdes et conserve éventuellement un tel rôle prédictif également pendant le traitement par blocage de l’IL-6.
Il a également été démontré que des anticorps dirigés contre le peptide de ferritine humaine sont présents chez plus de 90 % des patients atteints de GCA active, ce qui en fait un marqueur diagnostique potentiellement utile. Bien que tous ces nouveaux biomarqueurs semblent prometteurs, d’autres études sont nécessaires pour évaluer leur fiabilité et leur application dans la pratique clinique quotidienne.
23. Biopsie de l’artère temporale
Pendant des décennies, la biopsie artérielle a représenté le seul outil disponible pour confirmer le diagnostic de GCA.
En effet, réaliser une biopsie permet d’obtenir des preuves histologiques des processus inflammatoires qui caractérisent cette pathologie. L’intervention est presque toujours réalisée dans l’artère temporale superficielle, car ce site est facilement accessible et son ablation a des conséquences minimes.
2.3.1. Performances diagnostiques
TAB a une spécificité élevée pour le diagnostic de GCA (jusqu’à 100 %). Cependant, sa sensibilité est bien moindre. Les principales causes au-delà d’un résultat BAT faussement négatif sont un mauvais échantillonnage et la nature segmentée de l’inflammation dans les lésions vasculaires.
Si la suspicion clinique de GCA est élevée, la corticothérapie ne doit jamais être retardée pour le BAT. Cependant, il doit être obtenu dans les quatre semaines suivant le début du traitement, car des doses élevées de glucocorticoïdes peuvent conduire à une résolution progressive de l’infiltrat inflammatoire vasculaire.
2.3.2. Résultats histologiques
Dans les artères affectées par la GCA, on trouve généralement un infiltrat inflammatoire mixte transmural comprenant des lymphocytes, des macrophages et des cellules géantes. Un tissu inflammatoire plus épais entourant la lame élastique externe et un composant inflammatoire plus fin le long de la lame élastique interne confèrent au vaisseau un aspect caractéristique d’« anneaux concentriques ».
L’impact clinique de différents types d’infiltration lymphocytaire est à l’étude. Il semble que l’inflammation dépendante de Th1 puisse mal répondre aux glucocorticoïdes et pourrait être associée à un phénotype plus récidivant. Par conséquent, l’introduction précoce d’agents épargneurs de stéroïdes pourrait être bénéfique lorsque les cellules Th1 représentent la caractéristique histologique prédominante.
2.4. Images
De nos jours, les techniques d’imagerie sont essentielles au diagnostic de l’ACG. Ils doivent toujours être interprétés dans le contexte des résultats cliniques et de laboratoire pour éviter des diagnostics erronés. En revanche, son rôle dans le suivi des patients après le début du traitement et dans la définition de l’activité de la maladie n’est pas encore totalement élucidé.
2.4.1. Échographie artérielle Doppler couleur
Le rôle de l’échographie dans le diagnostic de l’ACG a été démontré pour la première fois en 1997, lorsque la présence d’un halo hypoéchogène non compressible caractéristique ( « signe de halo » ) a été constatée autour des artères temporales chez un patient atteint d’une nouvelle maladie. apparence. On pense que cette zone circonférentielle autour de la lumière vasculaire représente un œdème mural.
La présence du signe du halo bilatéral des artères temporales est très spécifique de l’ACG, tout comme sa visibilité persistante lors de la compression par la sonde échographique (« signe de compression »).
Au cours de la dernière décennie, l’échographie est devenue largement disponible et est désormais acceptée comme substitut diagnostique du BAT, à condition qu’elle soit réalisée par un clinicien expérimenté. Les directives européennes actuelles suggèrent que l’échographie soit choisie comme premier test de diagnostic dès l’apparition de la maladie, en raison de son faible caractère invasif et de la rapidité avec laquelle les résultats sont disponibles.
L’échographie a également été validée dans le but de surveiller les patients et d’évaluer la réponse au traitement. Une étude prospective récente a montré que le signe du halo est en corrélation avec les marqueurs de l’activité de la maladie et la dose cumulée de glucocorticoïdes. De plus, elle est présente dans plus de 90 % des rechutes de la maladie.
2.4.2. Tomographie par émission de positons au [18F]-fluorodésoxyglucose
Ces dernières années, l’utilisation du FDG-PET/CT a gagné en importance dans le diagnostic de l’ACG, car elle permet d’exclure d’autres diagnostics et de détecter la présence d’une atteinte de l’artère extracrânienne. L’artérite extracrânienne englobe généralement une inflammation diffuse de l’aorte et de ses branches, souvent atteintes bilatéralement. ( Figure 1a ). Par rapport à l’artérite de Takayasu, l’inflammation des artères mésentériques et rénales est exceptionnelle, tandis que les artères axillaires sont le plus fréquemment touchées.
Les lignes directrices actuelles suggèrent de demander une TEP/TDM au FDG chez les patients présentant des symptômes évocateurs d’ une artérite extracrânienne . Il convient de noter que les patients atteints de GV-ACG peuvent se présenter sans atteinte crânienne (c’est-à-dire absence de symptômes crâniens et US/TAB négatif). Dans ces cas, les études d’imagerie du corps entier (c’est-à-dire FDG-PET/CT, CTA et MRA) sont les seuls tests permettant d’identifier les lésions vasculitiques.
Bien que la sensibilité du FDG-PET/CT dans la détection de l’inflammation des artères extracrâniennes soit élevée dans les trois premiers jours suivant l’initiation des glucocorticoïdes, elle diminue de manière significative au cours des semaines suivantes. Pour conserver le pouvoir diagnostique du FDG-PET/CT, cette étude d’imagerie doit être réalisée peu de temps après le début du traitement.
2.4.3. Angiographie par résonance magnétique et tomodensitométrie
Le CTA est une technique répandue et facilement disponible. Une vascularite active se manifeste par un épaississement de la paroi et une augmentation du contraste mural. De plus, le CTA peut montrer des anomalies morphologiques telles qu’une sténose et des anévrismes. Cependant, le CTA n’est pas recommandé pour étudier les artères crâniennes en raison du manque de preuves à cet égard. De plus, elle est associée à une exposition importante aux radiations et nécessite un produit de contraste potentiellement néphrotoxique.
L’ARM est une technique non radiative qui permet également la détection de l’inflammation artérielle et des modifications luminales. Comme dans le CTA, le rehaussement et l’épaississement de la paroi avec le contraste au gadolinium sont des signes d’inflammation des vaisseaux ( Figure 1b ). Cette approche est recommandée si l’échographie n’est pas disponible ou peu concluante.
L’utilisation combinée du FDG-PET/CT et de l’ARM ou du CTA est particulièrement utile car elle permet de combiner une analyse quantitative de l’inflammation avec la caractérisation morphologique des vaisseaux. La présence d’une prise de contraste dans les vaisseaux métaboliquement actifs corrobore le diagnostic de vascularite et exclut d’autres causes d’absorption (par exemple, l’athérosclérose).
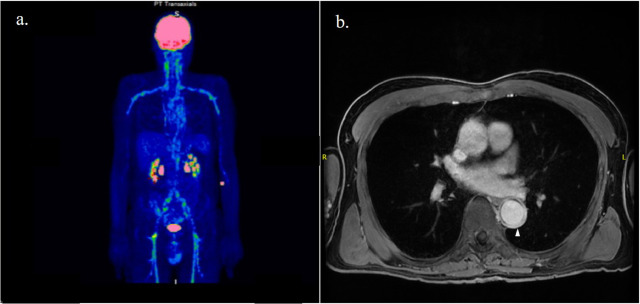
Figure 1. Patient atteint d’artérite à cellules géantes avec atteinte de l’aorte et de ses branches comme le montre la prise de contraste sur la tomographie par émission de positrons au [18F]-fluorodésoxyglucose ( a ) et l’épaississement de la paroi (pointe de la flèche) sur les examens d’angiographie par résonance magnétique ( b ).
3. Traitement
Le traitement de la GCA a trois objectifs principaux : i) atténuer le processus inflammatoire perturbé pour éviter les complications ischémiques aiguës ; ii) prévenir les rechutes de la maladie en utilisant la dose efficace la plus faible (le cas échéant) de glucocorticoïdes ; iii) prévenir les dommages vasculaires à long terme (c’est-à-dire anévrisme et sténose). Les glucocorticoïdes restent le pilier du traitement GCA. Cependant, l’ajout de médicaments antirhumatismaux modificateurs de la maladie (ARMM) peut être nécessaire pour obtenir et maintenir une rémission de la maladie dans certains cas.
3.1. Glucocorticoïdes
Des glucocorticoïdes systémiques à haute dose doivent être instaurés dès que le diagnostic de GCA est suspecté afin de prévenir les complications ischémiques.
Des études d’imagerie et histologiques doivent être obtenues dès que possible, mais ne doivent jamais retarder l’administration de glucocorticoïdes.
Les directives européennes actuelles recommandent une dose initiale de 1 mg/kg par jour d’équivalent prednisone, sans dépasser une dose quotidienne de 60 mg, car il n’existe aucune preuve suggérant un bénéfice supplémentaire. En cas de perte visuelle transitoire ou permanente, des impulsions intraveineuses de méthylprednisolone (0,25 à 1 g pendant trois jours maximum) peuvent être administrées avant de commencer les glucocorticoïdes oraux pour prévenir la progression des dommages ou une atteinte controlatérale. Cependant, une fois complètement établie, la perte de vision est rarement réversible, quelle que soit la voie d’administration.
Tout en réduisant la dose de glucocorticoïdes, la surveillance clinique et la mesure en série des réactifs de la phase aiguë sont essentielles pour identifier les rechutes de la maladie. Si une poussée est diagnostiquée, les glucocorticoïdes doivent être augmentés jusqu’à la dernière dose efficace ou, en cas de manifestations ischémiques, jusqu’à la dose d’induction.
Les risques associés à l’utilisation prolongée de glucocorticoïdes à doses modérées à élevées sont particulièrement accentués chez les patients atteints d’ACG en raison de l’âge avancé de cette population. Ils comprennent l’ostéoporose et les fractures osseuses liées à l’ostéoporose, les infections opportunistes courantes, l’hypertension artérielle, le diabète sucré et les hémorragies gastro-intestinales.
3.2. Agents d’épargne de stéroïdes
L’ajout d’un agent immunosuppresseur non stéroïdien peut être nécessaire chez certains patients sélectionnés atteints de GCA. Selon les directives européennes, les patients éligibles à un traitement d’appoint sont ceux atteints d’une maladie récalcitrante (c’est-à-dire que des rechutes sont observées lors de la diminution progressive des glucocorticoïdes) ou lorsque des facteurs de risque de complications liées aux stéroïdes sont présents.
3.2.1. Médicaments antirhumatismaux de fond conventionnels
Dans l’ensemble, les essais évaluant ce traitement d’appoint confirment son efficacité dans la réduction de la dose cumulée de glucocorticoïdes et du taux de rechute. Les directives européennes actuelles recommandent le méthotrexate comme alternative au tocilizumab. La dose minimale recommandée est de 15 mg par semaine.
3.2.2. Médicaments antirhumatismaux de fond biologiques
Le tocilizumab est un anticorps monoclonal qui cible le récepteur de l’IL-6 et exerce des effets anti-inflammatoires notables. Il peut être administré par voie sous-cutanée (à la dose hebdomadaire de 162 mg) ou par voie intraveineuse (à la dose mensuelle de 8 mg/kg). Chez les patients atteints d’ACG, l’ajout de tocilizumab entraîne des taux de rémission plus élevés que la monothérapie aux glucocorticoïdes, même lorsque les glucocorticoïdes sont diminués selon un régime accéléré (c’est-à-dire dans les six mois).
La durée optimale du traitement par tocilizumab est actuellement inconnue. L’arrêt brutal après un an est associé à un taux de rechute de 50 %. Par conséquent, la plupart des patients méritent un traitement plus long, peut-être à des doses plus faibles.
4. Rechutes et complications à long terme
Bien que la réponse aux glucocorticoïdes soit généralement satisfaisante, la GCA rechute pendant et après la diminution progressive du traitement. Les rechutes de GCA vont de l’inflammation subclinique qui ne peut être détectée que par des tests de laboratoire et de l’imagerie à des manifestations cliniquement évidentes.
Lorsqu’une rechute est diagnostiquée, les glucocorticoïdes doivent être augmentés jusqu’à la dernière dose efficace ou, en cas de manifestations ischémiques, jusqu’à la dose d’induction. Il est également recommandé de débuter des DMARD dans ce cas pour prévenir de nouvelles poussées de la maladie et réduire la dose cumulée de stéroïdes.
Outre le risque imminent de complications vasculaires telles que la cécité et les accidents vasculaires cérébraux, l’ACG englobe également des complications à long terme telles que les anévrismes et la sténose vasculaire. Les anévrismes de l’aorte peuvent compliquer l’histoire des patients atteints d’ACG dans jusqu’à 20 % des cas. Contrairement aux anévrismes liés à l’athérosclérose, les anévrismes liés à la GCA sont plus fréquemment observés dans l’aorte thoracique que dans le tractus abdominal.
5. Conclusions Au cours des dernières décennies, le spectre de l’ACG s’est élargi au-delà de la simple inflammation des vaisseaux crâniens. Cette pathologie peut désormais être considérée comme un syndrome vasculitique à multiples facettes. Bien que la GCA puisse entraîner une morbidité importante due à des lésions vasculaires aiguës et chroniques, l’approche diagnostique de cette maladie s’est nettement améliorée ces dernières années. L’introduction du tocilizumab dans l’algorithme thérapeutique a considérablement augmenté les chances de contrôler l’activité de la maladie chez la majorité des patients. Cependant, certaines questions sur la pathogenèse et l’histoire naturelle de la GCA restent en suspens et nécessitent des investigations plus approfondies. Une fois clarifiés, ces aspects amélioreront la prise en charge clinique et le pronostic des patients touchés par cette maladie. Chaque nouveau patient suspecté d’apparition d’une GCA doit subir une stadification appropriée, en utilisant les différentes techniques d’imagerie disponibles, pour établir l’étendue de la maladie (par exemple, GCA crânienne ou extracrânienne +/- PMR). Sur la base des données existantes, il est considéré que la prise en charge des patients atteints d’ACG crânienne et extracrânienne devrait suivre des voies différentes. Le premier groupe pourrait mériter des doses initiales plus élevées de glucocorticoïdes et bénéficier d’une monothérapie aux glucocorticoïdes, au moins dans les premiers stades. Au contraire, chez les patients atteints d’une maladie extracrânienne, l’introduction d’un agent épargneur de stéroïdes doit être recherchée d’emblée pour réduire la fréquence des poussées. Le tocilizumab doit toujours être l’agent antirhumatismal préféré, s’il n’est pas contre-indiqué, car son utilisation repose sur les données les plus solides. Cependant, on s’appuie beaucoup sur de nouveaux médicaments actuellement à l’étude, tels que le sécukinumab et les inhibiteurs de JAK. |