Il panel della Surviving Sepsis Campaign ha recentemente raccomandato che “i pazienti affetti da COVID-19 ventilati meccanicamente debbano essere trattati in modo simile ad altri pazienti con insufficienza respiratoria acuta in terapia intensiva [1]”.
Tuttavia, la polmonite da COVID-19 [2], nonostante rientri nella maggior parte dei casi secondo la definizione ARDS di Berlino [3], è una malattia specifica , le cui caratteristiche sono una grave ipossiemia spesso associata ad una compliance del sistema respiratorio quasi normale (più (oltre il 50% dei 150 pazienti misurati dagli autori e confermati da diversi colleghi del nord Italia).
Questa straordinaria combinazione non si riscontra quasi mai nell’ARDS grave.
Questi pazienti con ipossiemia grave nonostante condividano un’unica eziologia (SARS-CoV-2) possono presentarsi in modo molto diverso :
- Respirazione normale (ipossiemia “silenziosa”)
- Notevolmente dispnoico; abbastanza sensibile all’ossido nitrico o meno
- Profondamente ipocapnico o normo/ipercapnico.
- Sensibile alla posizione prona o meno.
Pertanto, la stessa malattia si presenta in realtà con vistose disomogeneità .
Sulla base dell’osservazione dettagliata di diversi casi e delle discussioni con i colleghi che hanno in cura questi pazienti, ipotizziamo che i diversi modelli di COVID-19 riscontrati al momento della presentazione al pronto soccorso dipendano dall’interazione tra tre fattori:
- La gravità dell’infezione, la risposta dell’ospite, la riserva fisiologica e le comorbidità.
- La capacità di risposta ventilatoria del paziente all’ipossiemia.
- Il tempo trascorso tra l’esordio della malattia e l’osservazione in ospedale.
L’interazione tra questi fattori porta allo sviluppo di uno spettro di malattie legate al tempo all’interno di due "fenotipi" primari:
|
Polmonite da COVID-19, tipo L
Inizialmente, la polmonite da COVID-19 presenta le seguenti caratteristiche:
- Bassa elastanza . Una compliance quasi normale indica che la quantità di gas nel polmone è quasi normale [4].
- Basso rapporto ventilazione-perfusione (VA/Q). Poiché il volume del gas è quasi normale, l’ipossiemia può essere meglio spiegata dalla perdita della regolazione della perfusione e dalla perdita della vasocostrizione ipossica. Di conseguenza, in questa fase, la pressione dell’arteria polmonare dovrebbe essere quasi normale .
- Basso peso polmonare. Alla TC sono presenti solo densità a vetro smerigliato, localizzate principalmente a livello subpleurico e lungo le fessure polmonari. Di conseguenza, il peso polmonare aumenta solo moderatamente.
- Bassa capacità di reclutamento polmonare. La quantità di tessuto non aerato è molto bassa; di conseguenza, la capacità di reclutamento è bassa [5].
Per concettualizzare questi fenomeni, ipotizziamo la seguente sequenza di eventi:
L’infezione virale porta ad un modesto edema interstiziale subpleurico locale (lesioni a vetro smerigliato) localizzato in particolare alle interfacce tra strutture polmonari con diverse proprietà elastiche, dove si concentrano stress e tensione [6].
La vasoplegia spiega la grave ipossiemia . La risposta normale all’ipossiemia è quella di aumentare la ventilazione minuto, principalmente aumentando il volume corrente [7] (fino a 15-20 ml/kg), che è associato a una pressione inspiratoria intratoracica più negativa.
Fattori indeterminati diversi dall’ipossiemia stimolano notevolmente il drive respiratorio in questi pazienti. Tuttavia, una compliance quasi normale spiega perché alcuni pazienti si presentano senza dispnea quando inalano il volume previsto. Questo aumento della ventilazione minuto porta ad una diminuzione della PaCO2.
L’evoluzione della malattia: transizione tra fenotipi
I pazienti di tipo L possono rimanere invariati per un periodo e poi migliorare o peggiorare. La possibile caratteristica chiave che determina la progressione della malattia, oltre alla gravità della malattia stessa, è la profondità della pressione intratoracica negativa associata all’aumento del volume corrente nella respirazione spontanea.
Infatti, la combinazione di una pressione intratoracica inspiratoria negativa e di una maggiore permeabilità polmonare dovuta all’infiammazione provoca un edema polmonare interstiziale . Questo fenomeno, inizialmente descritto da Barach in [8] e Mascheroni in [9] entrambi in ambito sperimentale, è stato recentemente riconosciuto come la principale causa di danno polmonare autoinflitto dal paziente (P-SILI) [10].
Nel corso del tempo, l’aumento dell’edema aumenta il peso polmonare, la pressione sovrapposta e l’atelettasia dipendente. Quando l’edema polmonare raggiunge una certa entità, il volume di gas nel polmone diminuisce e i volumi generati da una data pressione inspiratoria diminuiscono [11]. In questa fase si sviluppa dispnea, che a sua volta porta al peggioramento del danno polmonare autoinflitto del paziente (P-SILI).
Il passaggio dal tipo L al tipo H potrebbe essere dovuto da un lato all’evoluzione della polmonite da COVID-19 e dall’altro alle lesioni attribuibili alla ventilazione ad alto stress.
Polmonite da COVID-19, tipo H
Il paziente di tipo H:
- Elevata elasticità . La diminuzione del volume del gas dovuta all’aumento dell’edema spiega l’aumento dell’elastanza polmonare.
- Shunt alto da destra a sinistra . Ciò è dovuto alla frazione di gittata cardiaca che perfonde il tessuto non aerato che si sviluppa nelle regioni polmonari dipendenti a causa dell’aumento dell’edema e della pressione sovrapposta.
- Peso polmonare elevato . L’analisi quantitativa della tomografia computerizzata mostra un notevole aumento del peso polmonare (>1,5 kg), dell’ordine di grandezza dell’ARDS grave [12].
- Elevata capacità di reclutamento polmonare . La maggiore quantità di tessuto non aerato è associata, come nell’ARDS grave, ad una maggiore capacità di reclutamento [5].
Il modello di tipo H, nel 20-30% dei pazienti della nostra serie, soddisfa completamente i criteri di gravità dell’ARDS : ipossiemia, infiltrati bilaterali, ridotta compliance del sistema respiratorio, aumento del peso polmonare e potenziale di reclutamento.
La Figura 1 riassume l’andamento temporale che descriviamo. Nel pannello a, mostriamo la TC sulla respirazione spontanea di un paziente di tipo L al momento del ricovero e nel pannello b, la sua transizione al tipo H dopo 7 giorni di supporto non invasivo. Come mostrato, un grado simile di ipossiemia era associato a diversi modelli di imaging polmonare.
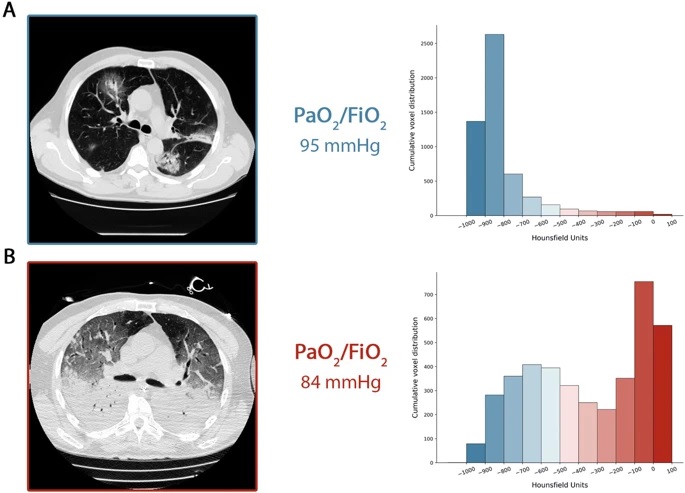 Una TAC acquisita durante la respirazione spontanea. La distribuzione cumulativa del numero CT si sposta a sinistra (compartimenti ben aerati), con il compartimento da 0 a -100 HU, il tessuto non aerato è praticamente 0. Infatti, il peso totale del tessuto polmonare era di 1108 g , il 7,8% non era aerato e il volume del gas era di 4228 ml. Paziente che riceve ossigeno con una frazione di ossigeno inspirata della maschera Venturi pari a 0,8. b CT acquisita durante la ventilazione meccanica alla pressione di fine espirazione a una PEEP di 5 cmH2O. La distribuzione cumulativa della scansione TC si sposta a destra (compartimenti non aerati), mentre i compartimenti di sinistra sono significativamente ridotti. Infatti, il peso totale del tessuto polmonare era di 2744 g, di cui il 54% non aerato e il volume del gas era di 1360 ml. Il paziente è stato ventilato in modalità volume controllato, 7,8 ml/kg di volume corrente, frequenza respiratoria di 20 respiri al minuto, frazione di ossigeno inspirato pari a 0,7
Una TAC acquisita durante la respirazione spontanea. La distribuzione cumulativa del numero CT si sposta a sinistra (compartimenti ben aerati), con il compartimento da 0 a -100 HU, il tessuto non aerato è praticamente 0. Infatti, il peso totale del tessuto polmonare era di 1108 g , il 7,8% non era aerato e il volume del gas era di 4228 ml. Paziente che riceve ossigeno con una frazione di ossigeno inspirata della maschera Venturi pari a 0,8. b CT acquisita durante la ventilazione meccanica alla pressione di fine espirazione a una PEEP di 5 cmH2O. La distribuzione cumulativa della scansione TC si sposta a destra (compartimenti non aerati), mentre i compartimenti di sinistra sono significativamente ridotti. Infatti, il peso totale del tessuto polmonare era di 2744 g, di cui il 54% non aerato e il volume del gas era di 1360 ml. Il paziente è stato ventilato in modalità volume controllato, 7,8 ml/kg di volume corrente, frequenza respiratoria di 20 respiri al minuto, frazione di ossigeno inspirato pari a 0,7
Trattamento respiratorio
Dato questo modello concettuale, ne consegue che il trattamento respiratorio offerto ai pazienti di tipo L e di tipo H deve essere diverso.
Il trattamento proposto è coerente con quanto osservato nel caso del COVID-19, sebbene il numero schiacciante di pazienti osservati in questa pandemia possa limitarne l’ampia applicabilità.
1) Il primo passo per invertire l’ipossiemia è attraverso un aumento della FiO2 a cui il paziente di tipo L risponde bene, in particolare se non presenta ancora dispnea.
2) Nei pazienti di tipo L con dispnea , sono disponibili diverse opzioni non invasive :
- Cannula nasale ad alto flusso (HFNC)
- Pressione positiva continua delle vie aeree (CPAP)
- Ventilazione non invasiva (NIV).
In questa fase, la misurazione (o stima) delle oscillazioni della pressione inspiratoria esofagea è cruciale [13]. In assenza di manometria esofagea, dovrebbero essere valutate misure surrogate del lavoro respiratorio, come le variazioni della pressione venosa centrale [14] o il rilevamento clinico di uno sforzo inspiratorio eccessivo.
Nei pazienti intubati si dovrebbe determinare anche l’occlusione P0.1 e P. Una PEEP elevata, in alcuni pazienti, può ridurre le variazioni della pressione pleurica e interrompere il circolo vizioso che esacerba il danno polmonare. Tuttavia, una PEEP elevata in pazienti normalmente collaboranti può avere effetti dannosi sull’emodinamica. In ogni caso, le opzioni non invasive sono discutibili, poiché possono essere associate ad alti tassi di fallimento e di intubazione tardiva , in una malattia che generalmente dura diverse settimane.
3) L’entità delle oscillazioni delle pressioni pleuriche inspiratorie può determinare la transizione dal fenotipo di Tipo L a quello di Tipo H. Poiché le variazioni della pressione esofagea aumentano da 5 a 10 cmH2O, che sono generalmente ben tollerate, a valori superiori a 15 cmH2O, aumenta il rischio di danno polmonare e pertanto l’intubazione deve essere eseguita il prima possibile.
4) Una volta intubati e sedati profondamente, i pazienti di tipo L, se ipercapnici , possono essere ventilati con volumi superiori a 6 ml/kg (fino a 8–9 ml/kg), poiché un’elevata compliance si traduce in una tensione tollerabile senza rischio di ventilazione indotta infortunio (VILI). La posizione prona dovrebbe essere utilizzata solo come manovra di salvataggio, poiché le condizioni polmonari sono "troppo buone" per l’efficacia della posizione prona, che si basa sul miglioramento dello stress e sulla ridistribuzione della tensione. La PEEP dovrebbe essere ridotta a 8-10 cmH2O, poiché la capacità di reclutamento è bassa e il rischio di fallimento emodinamico aumenta a livelli più alti.
L’intubazione precoce può impedire la transizione al fenotipo di tipo H.
5) I pazienti di tipo H dovrebbero essere trattati come ARDS grave, inclusa una PEEP più elevata, se compatibile con l’emodinamica, la posizione prona e il supporto extracorporeo.
|
















