Le panel de la campagne Surviving Sepsis a récemment recommandé que « les patients sous ventilation mécanique atteints de COVID-19 soient traités de la même manière que les autres patients souffrant d’insuffisance respiratoire aiguë en soins intensifs [1] ».
Cependant, la pneumonie COVID-19 [2], bien qu’elle tombe dans la plupart des cas selon la définition berlinoise du SDRA [3], est une maladie spécifique , dont les caractéristiques sont une hypoxémie sévère souvent associée à une complaisance du système respiratoire presque normale (plus plus de 50% des 150 patients mesurés par les auteurs et confirmés par plusieurs collègues du nord de l’Italie).
Cette combinaison remarquable n’est presque jamais observée dans les cas de SDRA sévère.
Ces patients présentant une hypoxémie sévère malgré une étiologie unique (SRAS-CoV-2) peuvent se présenter de manière très différente :
- Respiration normale (hypoxémie « silencieuse »)
- Notamment dyspnéique ; assez sensible au monoxyde d’azote ou non
- Profondément hypocapnique ou normo/hypercapnique.
- Sensible à la position couchée ou non.
Par conséquent, la même maladie se présente en réalité avec une non-uniformité frappante .
Sur la base de l’observation détaillée de plusieurs cas et de discussions avec des collègues traitant ces patients, nous émettons l’hypothèse que les différents profils de COVID-19 trouvés lors de la présentation aux urgences dépendent de l’interaction entre trois facteurs :
- La gravité de l’infection, la réponse de l’hôte, la réserve physiologique et les comorbidités.
- La capacité de réponse ventilatoire du patient à l’hypoxémie.
- Le temps écoulé entre le début de la maladie et l’observation à l’hôpital.
L’interaction entre ces facteurs conduit au développement d’un spectre de maladies liées au temps au sein de deux « phénotypes » principaux :
|
Pneumonie COVID-19, type L
Au début, la pneumonie COVID-19 présente les caractéristiques suivantes :
- Faible élastance . Une observance proche de la normale indique que la quantité de gaz dans les poumons est presque normale [4].
- Faible rapport ventilation-perfusion (VA/Q). Étant donné que le volume de gaz est proche de la normale, l’hypoxémie peut être mieux expliquée par une perte de régulation de la perfusion et une perte de vasoconstriction hypoxique. Par conséquent, à ce stade, la pression artérielle pulmonaire devrait être presque normale .
- Faible poids pulmonaire. Seules des densités en verre dépoli sont présentes au scanner, localisées principalement en sous-pleural et le long des fissures pulmonaires. Par conséquent, le poids des poumons n’augmente que modérément.
- Faible capacité de recrutement pulmonaire. La quantité de tissu non aéré est très faible ; par conséquent, la capacité de recrutement est faible [5].
Pour conceptualiser ces phénomènes, nous émettons l’hypothèse de la séquence d’événements suivante :
L’infection virale entraîne de modestes œdèmes interstitiels sous-pleuraux locaux (lésions en verre dépoli) particulièrement localisés aux interfaces entre des structures pulmonaires aux propriétés élastiques différentes, où se concentrent les contraintes et les tensions [6].
La vasoplégie explique l’hypoxémie sévère . La réponse normale à l’hypoxémie consiste à augmenter la ventilation minute, principalement en augmentant le volume courant [7] (jusqu’à 15-20 ml/kg), ce qui est associé à une pression inspiratoire intrathoracique plus négative.
Des facteurs indéterminés autres que l’hypoxémie stimulent notamment la pulsion respiratoire chez ces patients. Cependant, une observance quasi normale explique pourquoi certains patients se présentent sans dyspnée lorsqu’ils inhalent le volume attendu. Cette augmentation de la ventilation minute entraîne une diminution de la PaCO2.
L’évolution de la maladie : transition entre phénotypes
Les patients de type L peuvent rester inchangés pendant un certain temps, puis s’améliorer ou s’aggraver. La caractéristique clé possible qui détermine la progression de la maladie, outre la gravité de la maladie elle-même, est la profondeur de la pression intrathoracique négative associée à une augmentation du volume courant lors de la respiration spontanée.
En fait, la combinaison d’une pression intrathoracique inspiratoire négative et d’une perméabilité pulmonaire accrue due à l’inflammation entraîne un œdème pulmonaire interstitiel . Ce phénomène, initialement décrit par Barach dans [8] et Mascheroni dans [9] tous deux dans un cadre expérimental, a récemment été reconnu comme la principale cause de lésions pulmonaires auto-infligées par le patient (P-SILI) [10].
Au fil du temps, l’augmentation de l’œdème augmente le poids des poumons, la pression superposée et l’atélectasie dépendante. Lorsque l’œdème pulmonaire atteint une certaine ampleur, le volume de gaz dans le poumon diminue et les volumes générés par une pression inspiratoire donnée diminuent [11]. À ce stade, une dyspnée se développe, ce qui entraîne une aggravation de la lésion pulmonaire auto-infligée par le patient (P-SILI).
Le passage du type L au type H peut être dû à l’évolution de la pneumonie COVID-19 d’une part et aux blessures imputables à la ventilation à fort stress d’autre part.
Pneumonie COVID-19, type H
Le patient de type H :
- Haute élastance . La diminution du volume de gaz due à l’augmentation de l’œdème explique l’augmentation de l’élastance pulmonaire.
- Shunt haut de droite à gauche . Cela est dû à la fraction du débit cardiaque qui perfuse les tissus non aérés qui se développent dans les régions pulmonaires dépendantes en raison d’un œdème accru et d’une pression superposée.
- Poids pulmonaire élevé . L’analyse quantitative de la tomodensitométrie montre une augmentation notable du poids des poumons (> 1,5 kg), de l’ordre de grandeur d’un SDRA sévère [12].
- Capacité de recrutement pulmonaire élevée . La plus grande quantité de tissu non aéré est associée, comme dans le SDRA sévère, à une plus grande capacité de recrutement [5].
Le profil de type H, chez 20 à 30 % des patients de notre série, correspond parfaitement aux critères de sévérité du SDRA : hypoxémie, infiltrats bilatéraux, diminution de la compliance du système respiratoire, augmentation du poids pulmonaire et potentiel de recrutement.
La figure 1 résume l’évolution temporelle que nous décrivons. Dans le panneau a, nous montrons le scanner de la respiration spontanée d’un patient de type L à l’admission, et dans le panneau b, sa transition vers le type H après 7 jours de support non invasif. Comme indiqué, un degré similaire d’hypoxémie était associé à différents modèles d’imagerie pulmonaire.
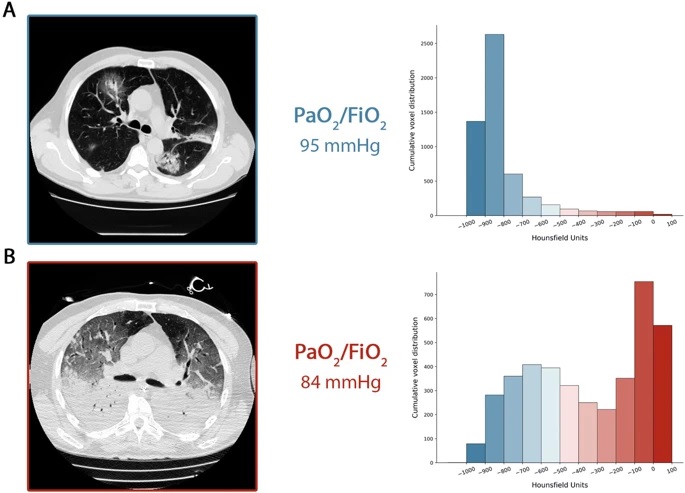 Un scanner acquis lors d’une respiration spontanée. La distribution cumulée du nombre CT se déplace vers la gauche (compartiments bien aérés), le compartiment allant de 0 à - 100 UH, le tissu non aéré étant pratiquement 0. En effet, le poids total du tissu pulmonaire était de 1108 g. , 7,8 % qui n’était pas aéré et le volume de gaz était de 4 228 ml. Patient recevant de l’oxygène avec une fraction d’oxygène au masque venturi inspiré de 0,8. b TDM acquis sous ventilation mécanique à une pression télé-expiratoire de 5 cmH2O PEP. La distribution cumulée du scanner se déplace vers la droite (compartiments non aérés), tandis que les compartiments gauches sont significativement réduits. En fait, le poids total du tissu pulmonaire était de 2 744 g, dont 54 % n’étaient pas aérés et le volume de gaz était de 1 360 ml. Le patient a été ventilé en mode volume contrôlé, volume courant de 7,8 ml/kg, fréquence respiratoire de 20 respirations par minute, fraction d’oxygène inspiré de 0,7.
Un scanner acquis lors d’une respiration spontanée. La distribution cumulée du nombre CT se déplace vers la gauche (compartiments bien aérés), le compartiment allant de 0 à - 100 UH, le tissu non aéré étant pratiquement 0. En effet, le poids total du tissu pulmonaire était de 1108 g. , 7,8 % qui n’était pas aéré et le volume de gaz était de 4 228 ml. Patient recevant de l’oxygène avec une fraction d’oxygène au masque venturi inspiré de 0,8. b TDM acquis sous ventilation mécanique à une pression télé-expiratoire de 5 cmH2O PEP. La distribution cumulée du scanner se déplace vers la droite (compartiments non aérés), tandis que les compartiments gauches sont significativement réduits. En fait, le poids total du tissu pulmonaire était de 2 744 g, dont 54 % n’étaient pas aérés et le volume de gaz était de 1 360 ml. Le patient a été ventilé en mode volume contrôlé, volume courant de 7,8 ml/kg, fréquence respiratoire de 20 respirations par minute, fraction d’oxygène inspiré de 0,7.
Traitement respiratoire
Compte tenu de ce modèle conceptuel, il s’ensuit que le traitement respiratoire proposé aux patients de type L et de type H doit être différent.
Le traitement proposé est conforme à ce qui a été observé dans le cas du COVID-19, bien que le nombre écrasant de patients vus dans cette pandémie puisse limiter sa large applicabilité.
1) La première étape pour inverser l’hypoxémie consiste à augmenter la FiO2 à laquelle le patient de type L répond bien, en particulier s’il ne souffre pas encore de dyspnée.
2) Chez les patients de type L souffrant de dyspnée , plusieurs options non invasives sont disponibles :
- Canule nasale à haut débit (HFNC)
- Pression positive continue des voies respiratoires (CPAP)
- Ventilation non invasive (VNI).
A ce stade, la mesure (ou l’estimation) des oscillations de la pression inspiratoire œsophagienne est cruciale [13]. En l’absence de manométrie œsophagienne, des mesures de substitution du travail respiratoire, telles que des modifications de la pression veineuse centrale [14] ou la détection clinique d’un effort inspiratoire excessif, doivent être évaluées.
Chez les patients intubés , P0,1 et P occlusion doivent également être déterminés. Une PEP élevée, chez certains patients, peut diminuer les changements de pression pleurale et arrêter le cercle vicieux qui exacerbe les lésions pulmonaires. Cependant, une PEP élevée chez des patients normalement conformes peut avoir des effets néfastes sur l’hémodynamique. Dans tous les cas, les options non invasives sont discutables, car elles peuvent être associées à des taux d’échec élevés et à une intubation tardive , dans une maladie qui dure généralement plusieurs semaines.
3) L’ampleur des oscillations des pressions pleurales inspiratoires peut déterminer la transition du phénotype de type L au phénotype de type H. À mesure que les changements de pression œsophagienne augmentent de 5 à 10 cmH2O, qui sont généralement bien tolérés, à plus de 15 cmH2O, le risque de lésion pulmonaire augmente et l’intubation doit donc être effectuée dès que possible.
4) Une fois intubés et profondément sous sédation, les patients de type L, s’ils sont hypercapniques , peuvent être ventilés avec des volumes supérieurs à 6 ml/kg (jusqu’à 8 à 9 ml/kg), car une observance élevée entraîne une tension tolérable sans risque de contraction induite par la ventilation. blessure (VILI). La position couchée ne doit être utilisée que comme manœuvre de sauvetage, car les conditions pulmonaires sont « trop bonnes » pour l’efficacité de la position couchée, qui repose sur l’amélioration du stress et la redistribution des tensions. La PEP doit être réduite à 8-10 cmH2O, car la capacité de recrutement est faible et le risque d’échec hémodynamique augmente à des niveaux plus élevés.
Une intubation précoce peut empêcher la transition vers le phénotype de type H.
5) Les patients de type H doivent être traités comme un SDRA sévère, y compris une PEP plus élevée, si cela est compatible avec l’hémodynamique, la position couchée et le soutien extracorporel.
|
















