Résumé La carie de la petite enfance est une maladie bucco-dentaire grave qui provoque une carie dentaire agressive. En particulier, une association synergique entre un champignon, Candida albicans, et une bactérie cariogène, Streptococcus mutans, favorise le développement de biofilms très acides et difficiles à éliminer, aggravant les dommages virulents. Ces interactions sont largement médiées par les glycosyltransférases (GtfB) qui lient les mannanes dans la paroi cellulaire de C. albicans. Nous présentons ici une approche enzymatique pour cibler les interactions GtfB-mannane dans ce consortium inter-royaumes utilisant des exo- et endoenzymes dégradant le mannane. Ces exo- et endoenzymes sont très efficaces pour réduire la biomasse du biofilm sans tuer les micro-organismes, ainsi que pour atténuer la production d’un environnement au pH acide qui conduit à la carie dentaire. Pour corroborer ces résultats, nous présentons des preuves biophysiques utilisant la microscopie à force atomique d’une molécule unique, le cisaillement de biofilm et l’analyse de la topographie de la surface de l’émail. Les données montrent une diminution drastique des forces de liaison du GtfB à C. albicans (réduction d’environ 15 fois) après un traitement enzymatique. De plus, l’activité enzymatique a perturbé la stabilité mécanique du biofilm et réduit considérablement la déminéralisation de l’émail dentaire humain sans effets cytotoxiques sur les kératinocytes gingivaux. Nos résultats représentent un progrès significatif vers une nouvelle intervention thérapeutique non biocide contre les biofilms bactériens et fongiques pathogènes ciblant les interactions de liaison ligand-récepteur entre royaumes. Importance La formation de biofilm est un facteur de virulence clé responsable de diverses maladies infectieuses. En particulier, les interactions entre un champignon, Candida albicans, et une bactérie, Streptococcus mutans, sont connues pour jouer un rôle important dans la pathogenèse des caries dentaires. Bien que certains antimicrobiens aient été appliqués pour traiter des maladies associées à des biofilms impliqués par des champignons, ils manquent souvent d’interactions polymicrobiennes ciblées. En outre, ils pourraient ne pas être appropriés à des mesures préventives, car ces antimicrobiens pourraient altérer le microbiote écologique et/ou induire la prévalence d’une résistance aux médicaments au fil du temps. En ciblant spécifiquement le mécanisme d’interaction par lequel les mannoprotéines à la surface de C. albicans interviennent dans les interactions entre royaumes, nous démontrons que les enzymes qui dégradent les mannoprotéines peuvent perturber efficacement les interactions des biofilms sans effets microbicides ou sans provoquer de cytotoxicité dans les cellules. cellules humaines. Cela suggère une application potentielle en tant qu’approche ciblée pour intervenir dans un biofilm pathogène inter-royaume associé à une maladie bucco-dentaire coûteuse et non résolue. |
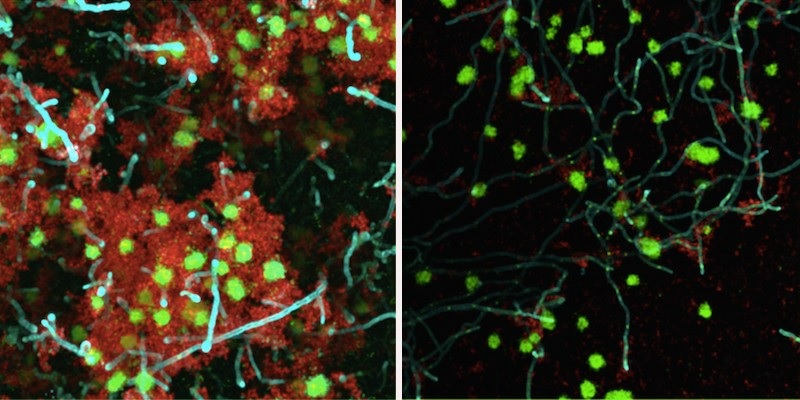
Un traitement enzymatique a considérablement affaibli un biofilm de bactéries et de levures sur une surface semblable à une dent. Cette approche thérapeutique, qui utilise la bêta-mannanase (panneau de droite) pour rompre les liens entre bactéries et levures, pourrait être utilisée pour traiter les caries de la petite enfance, une forme grave de carie dentaire. (Image : avec l’aimable autorisation de Geelsu Hwang)
commentaires
En ciblant les liens entre les bactéries et les levures qui peuvent former la plaque dentaire, une nouvelle stratégie thérapeutique pourrait aider à éliminer cette accumulation sans affecter les tissus bucco-dentaires, selon une nouvelle étude réalisée par une équipe de l’Université de Pennsylvanie.
La combinaison d’un régime riche en glucides et d’une mauvaise hygiène bucco-dentaire peut entraîner chez les enfants des caries de la petite enfance (CPE), une forme grave de carie dentaire qui peut avoir un impact durable sur leur santé bucco-dentaire et globale.
Il y a quelques années, des scientifiques de la Penn’s School of Dental Medicine ont découvert que la plaque dentaire à l’origine du CPB est composée à la fois d’une espèce bactérienne, Streptococcus mutans , et d’un champignon, Candida albicans . Les deux forment une symbiose collante, connue scientifiquement sous le nom de biofilm, qui devient extrêmement virulente et difficile à déloger de la surface de la dent.
Aujourd’hui, une nouvelle étude du groupe propose une stratégie pour perturber ce biofilm en ciblant les interactions levure-bactérie qui rendent les plaques ECC si intraitables. Contrairement à certains traitements actuels contre le CPB, qui utilisent des agents antimicrobiens pouvant avoir des effets indésirables et potentiellement endommager les tissus sains, ce traitement utilise une enzyme spécifique aux liaisons qui existent entre les microbes.
"Nous avons pensé que cela pourrait être une nouvelle façon de résoudre le problème de la CEC en intervenant dans l’interaction synergique entre les bactéries et les levures", explique Geelsu Hwang, professeur adjoint à Penn Dental Medicine et auteur principal de l’étude publiée dans la revue. mBio. "Cela nous donne un autre outil pour perturber ce biofilm virulent."
Le travail s’appuie sur les résultats d’un article de 2017 rédigé par Hwang et ses collègues, dont Hyun (Michel) Koo de Penn Dental Medicine, qui ont découvert que des molécules appelées mannanes dans la paroi cellulaire de Candida se lient étroitement à une enzyme sécrétée par S. mutans, les glycosyltransférases ( Gftb). ). En plus de faciliter la liaison entre royaumes, Gftb contribue également à la résistance des biofilms dentaires en fabriquant des polymères de type colle appelés glucanes en présence de sucres.
Bien que certains cas de CPE soient traités avec des médicaments qui tuent directement les microbes, réduisant potentiellement le nombre d’agents pathogènes dans la bouche, cela ne détruit pas toujours efficacement le biofilm et peut avoir des effets indésirables sur les « bons » microbes ainsi que sur les tissus mous. de la cavité buccale.
Hwang et ses collègues voulaient essayer une approche différente ciblant directement l’interaction insidieuse entre la levure et les bactéries et ont choisi de cibler les mannanes à la surface de la cellule Candida comme point de contact.
En utilisant trois enzymes différentes dégradant le mannane , ils ont appliqué chacune d’elles sur un biofilm se développant sur une surface semblable à une dent dans un milieu de salive humaine et l’ont laissé pendant cinq minutes. Après traitement, ils ont remarqué que le volume total du biofilm était réduit. Grâce à une microscopie puissante, ils ont également observé des réductions spectaculaires de l’épaisseur du biofilm et des interactions entre bactéries et levures. Le pH du milieu environnant était plus élevé lorsqu’il était exposé aux enzymes, indiquant un environnement moins acide et donc moins propice à la carie dentaire.
Ils ont également mesuré la facilité avec laquelle le biofilm se décompose après le traitement, à l’aide d’un appareil qui applique une tension, comme si vous vous brossiez les dents.
"La structure du biofilm était plus fragile après le traitement enzymatique", explique Hwang. "Nous avons pu constater que les biofilms s’éliminaient plus facilement."
Pour confirmer le mécanisme de leur approche, à savoir que les enzymes dégradant le mannane affaiblissaient la liaison entre la levure et les bactéries, l’équipe a utilisé la microscopie à force atomique pour mesurer les liaisons entre Candida et Gftb. Ils ont constaté que la thérapie réduisait cette force de liaison de 15 fois.
Enfin, ils voulaient avoir une idée de la façon dont ces enzymes seraient bien tolérées lorsqu’elles seraient utilisées dans la cavité buccale, d’autant plus que les enfants seraient le groupe de patients cible.
Lors de l’application des enzymes sur des cellules gingivales humaines en culture, ils n’ont trouvé aucun impact nocif, même lorsqu’ils utilisaient une forme concentrée des enzymes. De plus, ils ont observé que le traitement ne tuait ni les bactéries ni les levures, signe qu’il pouvait fonctionner même si les microbes développaient des mutations qui leur conféreraient une résistance à d’autres types de thérapies.
Les chercheurs ont maintenu le temps d’application relativement court à cinq minutes, bien qu’ils s’attendent à constater une activité dans un délai encore plus court, comme les deux minutes recommandées pour le brossage des dents. Hwang dit qu’ils peuvent envisager un bain de bouche sans alcool avec ces enzymes ajoutées que les enfants pourraient utiliser comme mesure préventive contre les maladies coronariennes.
Les chercheurs espèrent continuer à explorer cette possibilité avec un suivi supplémentaire, notamment en testant ces enzymes sur un modèle animal. Avec d’autres succès, ils visent à ajouter un autre outil pour lutter contre la menace pour la santé publique des maladies coronariennes.
















