Zusammenfassung Frühkindliche Karies ist eine schwere Munderkrankung, die zu aggressivem Zahnverfall führt. Insbesondere eine synergistische Verbindung zwischen einem Pilz, Candida albicans, und einem kariogenen Bakterium, Streptococcus mutans, fördert die Entwicklung sehr saurer Biofilme, die schwer zu beseitigen sind und virulente Schäden verschlimmern. Diese Wechselwirkungen werden größtenteils durch Glykosyltransferasen (GtfB) vermittelt, die Mannane in der Zellwand von C. albicans binden. Hier stellen wir einen enzymatischen Ansatz vor, um GtfB-Mannan-Wechselwirkungen in diesem königreichsübergreifenden Konsortium unter Verwendung von Mannan-abbauenden Exo- und Endoenzymen zu bekämpfen. Diese Exo- und Endoenzyme sind hochwirksam bei der Reduzierung der Biofilm-Biomasse, ohne Mikroorganismen abzutöten, und mildern die Entstehung eines sauren pH-Milieues, das zu Zahnkaries führt. Um diese Ergebnisse zu untermauern, präsentieren wir biophysikalische Beweise mithilfe der Einzelmolekül-Rasterkraftmikroskopie, der Biofilmscherung und der Analyse der Schmelzoberflächentopographie. Die Daten zeigen eine drastische Abnahme der Bindungskräfte von GtfB an C. albicans (ca. 15-fache Reduktion) nach enzymatischer Behandlung. Darüber hinaus störte die enzymatische Aktivität die mechanische Stabilität des Biofilms und reduzierte die Demineralisierung des menschlichen Zahnschmelzes deutlich, ohne zytotoxische Auswirkungen auf gingivale Keratinozyten. Unsere Ergebnisse stellen einen bedeutenden Fortschritt auf dem Weg zu einer neuartigen nicht-bioziden therapeutischen Intervention gegen pathogene Bakterien- und Pilzbiofilme dar, die auf Liganden-Rezeptor-Bindungsinteraktionen zwischen verschiedenen Königreichen abzielt. Bedeutung Die Bildung von Biofilmen ist ein zentraler Virulenzfaktor, der für verschiedene Infektionskrankheiten verantwortlich ist. Insbesondere Wechselwirkungen zwischen einem Pilz, Candida albicans, und einem Bakterium, Streptococcus mutans, spielen bekanntermaßen eine wichtige Rolle bei der Pathogenese von Zahnkaries. Obwohl einige antimikrobielle Mittel zur Behandlung von Krankheiten eingesetzt werden, die mit pilzbefallenen Biofilmen einhergehen, mangelt es diesen häufig an gezielten polymikrobiellen Wechselwirkungen. Darüber hinaus sind diese möglicherweise nicht für vorbeugende Maßnahmen geeignet, da diese antimikrobiellen Mittel die ökologische Mikrobiota verändern und/oder im Laufe der Zeit die Prävalenz von Arzneimittelresistenzen induzieren können. Indem wir speziell auf den Interaktionsmechanismus abzielen, durch den Mannoproteine auf der Oberfläche von C. albicans die Wechselwirkung zwischen verschiedenen Königreichen vermitteln, zeigen wir, dass Enzyme, die Mannoproteine abbauen, Biofilm-Interaktionen ohne mikrobizide Wirkung oder ohne Zytotoxizität in den Zellen wirksam stören können. menschliche Zellen. Dies legt eine mögliche Anwendung als gezielten Ansatz nahe, um in einen königreichsübergreifenden pathogenen Biofilm einzugreifen, der mit einer kostspieligen und ungelösten Munderkrankung verbunden ist. |
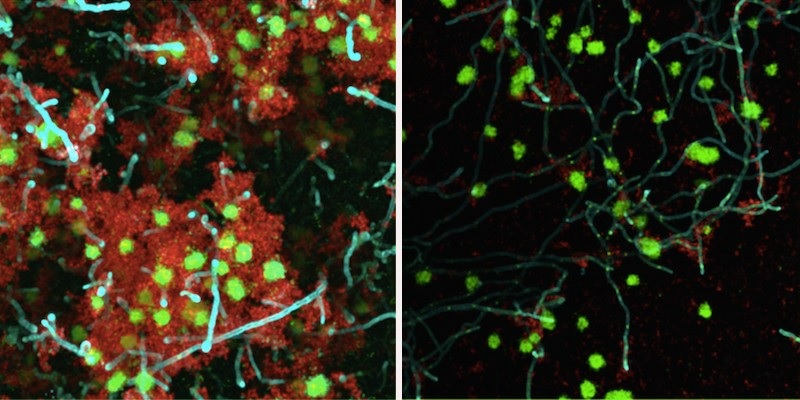
Eine enzymatische Behandlung schwächte einen Bakterien-Hefe-Biofilm auf einer zahnähnlichen Oberfläche deutlich. Dieser therapeutische Ansatz, der Beta-Mannanase (rechtes Bild) nutzt, um die Verbindungen zwischen Bakterien und Hefen aufzubrechen, könnte zur Behandlung von frühkindlicher Karies, einer schweren Form von Karies, eingesetzt werden. (Bild: Mit freundlicher Genehmigung von Geelsu Hwang)
Kommentare
Laut einer neuen Studie eines Teams der University of Pennsylvania könnte eine neue Therapiestrategie dabei helfen, die Ablagerungen zu beseitigen, ohne das Mundgewebe zu beeinträchtigen, indem sie auf Verbindungen zwischen Bakterien und Hefen abzielt, die Zahnbelag bilden können.
Die Kombination aus einer kohlenhydratreichen Ernährung und schlechter Mundhygiene kann dazu führen, dass Kinder an frühkindlicher Karies (ECC) erkranken, einer schweren Form von Karies, die sich nachhaltig auf ihre Mund- und allgemeine Gesundheit auswirken kann.
Vor einigen Jahren entdeckten Wissenschaftler der Penn’s School of Dental Medicine, dass der Zahnbelag, der CPB verursacht, sowohl aus einer Bakterienart, Streptococcus mutans , als auch aus einem Pilz, Candida albicans , besteht . Die beiden bilden eine klebrige Symbiose, wissenschaftlich als Biofilm bekannt, der extrem virulent wird und sich nur schwer von der Zahnoberfläche entfernen lässt.
Nun bietet eine neue Studie der Gruppe eine Strategie zur Zerstörung dieses Biofilms an, indem sie auf die Hefe-Bakterien-Interaktionen abzielt , die ECC-Plaques so unbehandelbar machen. Im Gegensatz zu einigen aktuellen CPB-Behandlungen, bei denen antimikrobielle Wirkstoffe eingesetzt werden, die unerwünschte Wirkungen haben und möglicherweise gesundes Gewebe schädigen können, verwendet diese Behandlung ein Enzym, das für die Bindungen zwischen Mikroben spezifisch ist.
„Wir dachten, dies könnte ein neuer Weg sein, das CEC-Problem anzugehen, der in die synergistische Interaktion zwischen Bakterien und Hefen eingreifen würde“, sagt Geelsu Hwang, Assistenzprofessor an der Penn Dental Medicine und leitender Autor der in der Zeitschrift veröffentlichten Studie. mBio. „Damit haben wir ein weiteres Werkzeug, um diesen virulenten Biofilm zu zerstören.“
Die Arbeit baut auf Erkenntnissen aus einer Arbeit von Hwang und Kollegen aus dem Jahr 2017 auf, darunter Hyun (Michel) Koo von Penn Dental Medicine, die herausfanden, dass Moleküle namens Mannane in der Zellwand von Candida fest an ein von S. mutans abgesondertes Enzym, die Glykosyltransferasen, binden ( Gftb). ). Gftb erleichtert nicht nur die Bindung zwischen verschiedenen Königreichen, sondern trägt auch zur Hartnäckigkeit von Zahnbiofilmen bei, indem es in Gegenwart von Zuckern klebstoffartige Polymere namens Glucane herstellt.
Während einige Fälle von ECC mit Medikamenten behandelt werden, die die Mikroben direkt abtöten und so möglicherweise die Anzahl der Krankheitserreger im Mund reduzieren, wird der Biofilm dadurch nicht immer effektiv abgebaut und kann unerwünschte Auswirkungen auf „gute“ Mikroben sowie das Weichgewebe haben der Mundhöhle.
Hwang und seine Kollegen wollten einen anderen Ansatz ausprobieren, der direkt auf die heimtückische Wechselwirkung zwischen Hefe und Bakterien abzielt, und entschieden sich dafür, Mannane auf der Oberfläche der Candida-Zelle als Kontaktpunkt ins Visier zu nehmen.
Mit drei verschiedenen Mannan- abbauenden Enzymen trugen sie jeweils ein menschliches Speichelmedium auf einen auf einer zahnähnlichen Oberfläche wachsenden Biofilm auf und ließen es fünf Minuten lang stehen. Nach der Behandlung stellten sie fest, dass sich das Gesamtvolumen des Biofilms verringerte. Mithilfe leistungsstarker Mikroskopie beobachteten sie außerdem eine dramatische Verringerung der Biofilmdicke und der Wechselwirkungen zwischen Bakterien und Hefen. Der pH-Wert des umgebenden Mediums war höher, wenn es den Enzymen ausgesetzt war, was auf eine Umgebung hindeutet, die nicht so sauer und daher weniger begünstigend für Karies ist.
Sie haben auch gemessen, wie einfach es war, den Biofilm nach der Behandlung abzubauen, indem sie ein Gerät verwendeten, das Spannung ausübt, ähnlich wie beim Zähneputzen.
„Die Biofilmstruktur war nach der Enzymbehandlung fragiler“, sagt Hwang. „Wir konnten sehen, dass sich die Biofilme leichter entfernen ließen.“
Um den Mechanismus ihres Ansatzes zu bestätigen, dass Mannan abbauende Enzyme die Bindung zwischen Hefe und Bakterien schwächen, verwendete das Team Rasterkraftmikroskopie, um die Bindungen zwischen Candida und Gftb zu messen. Sie fanden heraus, dass die Therapie diese Bindungsstärke um das 15-fache reduzierte.
Schließlich wollten sie eine Vorstellung davon bekommen, wie gut diese Enzyme bei der Anwendung in der Mundhöhle verträglich sind, insbesondere da Kinder die Zielgruppe der Patienten wären.
Bei der Anwendung der Enzyme auf menschliche Zahnfleischzellen in Kultur stellten sie keine schädlichen Auswirkungen fest, selbst wenn sie eine konzentrierte Form der Enzyme verwendeten. Darüber hinaus stellten sie fest, dass die Behandlung weder Bakterien noch Hefen abtötete, ein Zeichen dafür, dass sie auch dann wirken könnte, wenn die Mikroben Mutationen entwickelten, die ihnen Resistenzen gegen andere Arten von Therapien verleihen würden.
Die Forscher haben die Anwendungszeit mit fünf Minuten relativ kurz gehalten, gehen jedoch davon aus, dass die Wirkung schon nach einer noch kürzeren Zeit eintreten wird, etwa in den zwei Minuten, die zum Zähneputzen empfohlen werden. Hwang sagt, dass sie über ein alkoholfreies Mundwasser mit diesen zusätzlichen Enzymen nachdenken könnten, das Kinder als vorbeugende Maßnahme gegen KHK verwenden könnten.
Die Forscher hoffen, diese Möglichkeit mit weiteren Folgemaßnahmen weiterverfolgen zu können, einschließlich der Erprobung dieser Enzyme in einem Tiermodell. Mit weiteren Erfolgen wollen sie ein weiteres Instrument zur Bekämpfung der Bedrohung der öffentlichen Gesundheit durch KHK hinzufügen.
















