Les réponses des lymphocytes T jouent probablement un rôle important dans le contrôle de l’infection par le SRAS-CoV-2, mais ont été relativement peu étudiées. Les données suggèrent désormais que la plupart des personnes infectées développent une immunité cellulaire T robuste et durable, ce qui a des implications sur la durabilité de l’immunité et sur les futures approches vaccinales.
Les infections par le SRAS-CoV-2 entraînent des résultats cliniques très hétérogènes, allant de l’absence de symptômes à une maladie grave et au décès. Compte tenu de l’adéquation de ce virus chez l’homme jusqu’à présent et de sa persistance probable dans ce réservoir, il est important de comprendre la qualité et la durabilité de la mémoire immunologique produite par l’infection.
Bien que plusieurs études aient rapporté que les individus développent des réponses robustes des lymphocytes T mémoire spécifiques au SRAS-CoV-2 après une infection naturelle, il n’est pas clair si ces réponses sont en corrélation avec les résultats cliniques ou immunologiques. Dans le numéro actuel de Nature Immunology, Zuo et al.6 caractérisent la durabilité et la diversité des réponses des lymphocytes T mémoire établies après un COVID-19 asymptomatique ou léger.
Les auteurs ont étudié les réponses des lymphocytes T six mois après l’infection chez 100 personnes (âge médian 41 ans) qui présentaient des infections relativement bénignes (56 personnes) ou des infections asymptomatiques (44 personnes). Pour énumérer les cellules T qui ont reconnu le SRAS-CoV-2, les cellules d’individus précédemment infectés ont été d’abord stimulées avec des peptides des protéines du SRAS-CoV-2 pour provoquer une réponse cytokine. Les lymphocytes T réactifs au SRAS-CoV-2 ont ensuite été comptés sur la base de la sécrétion de l’interféron cytokine proinflammatoire (IFN)-γ dans un test ELISpot (coloration immuno-enzymatique). Presque tous les donneurs ont eu une réponse réactive des lymphocytes T au SRAS-CoV-2 dans cet essai.
Cependant, l’ampleur des réponses était très variable au sein de la cohorte, et un corrélat de la réponse était la présence de symptômes au début de l’infection. Les personnes présentant une infection symptomatique par le SRAS-CoV-2 présentaient des réponses des lymphocytes T producteurs d’IFN-γ d’une ampleur significativement plus grande six mois après l’infection par rapport à celles présentant une infection asymptomatique. Bien que les personnes atteintes d’une maladie grave n’aient pas été incluses dans cette étude, un autre rapport récent n’a trouvé aucune différence significative dans l’ampleur des réponses des lymphocytes T spécifiques du SRAS-CoV-2 entre les participants hospitalisés et ceux qui ne l’étaient pas.
Il est important de noter que les réponses des cellules T productrices d’IFN-γ ne correspondaient pas à l’âge des sujets de la cohorte. Associées à un rapport distinct révélant que les réponses des lymphocytes T chez les patients atteints de COVID-19 augmentaient avec l’âge7, les données sont rassurantes sur le fait que l’infection par le SRAS-CoV-2 peut provoquer des réponses robustes des lymphocytes T quel que soit l’âge.
La qualité de la réponse des lymphocytes T a ensuite été caractérisée avec une plus grande granularité en quantifiant les sous-ensembles de lymphocytes T CD4+ et CD8+ spécifiques du virus et la production de cytokines intracellulaires (IFN-γ, interleukine (IL)-2, IL-4 et facteur de nécrose tumorale). par ces cellules. Les lymphocytes T CD4+ spécifiques du SRAS-CoV-2 étaient environ deux fois plus abondants que les lymphocytes T CD8+, et la production de cytokines différait entre ces populations ; par exemple, plus d’IL-2 a été produite dans les cellules T CD4+, mais plus d’IFN-γ a été produite dans les cellules T CD8+.
La plus grande réponse des lymphocytes T CD4+ par rapport à CD8+ est cohérente avec les résultats d’un rapport distinct5, qui a analysé 43 patients 6 à 8 mois après l’infection, et est indépendant de l’âge, du sexe ou du fait que l’infection initiale était symptomatique. Fait intéressant, l’IL-2, avec ou sans IFN-γ, était la cytokine CD4+ dominante produite en réponse à la fois à la stimulation des protéines de pointe (S) et sans pointe, et cela a été confirmé par l’analyse du surnageant de culture cellulaire ELISpot. .
Zuo et coll. Nous avons ensuite étudié si l’ampleur de la réponse IFN-γ des lymphocytes T six mois après l’infection était en corrélation avec la réponse en anticorps au fil du temps. Une caractéristique intéressante de cette étude était la caractérisation mensuelle des anticorps après le diagnostic. Ceci a permis une analyse cinétique des niveaux d’IgG spécifiques de la protéine et de la nucléoprotéine (N) du SRAS-CoV-2 S. Ces niveaux étaient très hétérogènes parmi les participants à l’étude.
En moyenne, les réponses IgG ont commencé à diminuer après environ deux mois, mais sont restées bien au-dessus de la limite de détection chez la plupart des sujets à cinq mois.
Il est intéressant de noter qu’une plus grande ampleur de la réponse des lymphocytes T spécifiques S à six mois était corrélée à des niveaux maximaux d’anticorps plus élevés contre les protéines S et N et à une réponse soutenue en anticorps contre la protéine N. Il reste à déterminer si la réponse des lymphocytes T est associée à d’autres caractéristiques de l’anticorps (par exemple, capacité neutralisante et/ou autres fonctions effectrices) et/ou si d’autres caractéristiques de la réponse des lymphocytes T (par exemple, production d’IL par les cellules T CD4+)-2) sont également associés à une réponse anticorps maximale.
Bien que la réponse des lymphocytes T ait été évaluée dans cette étude six mois après l’infection, il n’est pas clair si des participants ont été réinfectés pendant cette période. Cela est peu probable, compte tenu du faible taux de réinfections dans les six mois suivant une primo-infection par le SRAS-CoV-2, mais cela aurait pu influencer les mesures de certains participants.
En outre, bien que les auteurs aient évalué la réponse des lymphocytes T par rapport à la réponse en anticorps antérieure, il sera important pour les études futures d’évaluer si la réponse précoce des lymphocytes T CD4+ prédit la qualité et/ou la durabilité de la réponse en anticorps. au fil du temps. Par exemple, on pense que les cellules T auxiliaires folliculaires (TFH) jouent un rôle essentiel dans l’aide aux cellules B et dans la formation de la mémoire immunitaire humorale, et des populations circulantes de ces cellules ont été identifiées en corrélation avec le développement d’anticorps antiviraux neutralisants9.
Un article récent a démontré que les fréquences des cellules CD40L + OX40 + TFH spécifiques du SRAS-CoV-2 en circulation étaient stables sur plusieurs mois. Il sera important de savoir si l’ampleur ou la qualité des cellules TFH spécifiques de l’antigène ou d’autres types de cellules en circulation à des moments précoces prédit la qualité et/ou la durabilité des anticorps ultérieurs.
Le fait que la majorité des lymphocytes T CD4+ et CD8+ aient été activés par des épitopes viraux non-S a des implications pour la vaccination dans les populations qui ont déjà connu des infections par le SRAS-CoV-2. Pour activer ces cellules T non réactives au S qui se sont établies lors des infections, des protéines en plus du S pourraient être incorporées dans les vaccins ; cela pourrait améliorer les réponses des anticorps neutralisants et non neutralisants en provoquant une réponse des lymphocytes T CD4 + plus robuste et susciterait une plus grande réponse des lymphocytes T CD8 + qui avaient été activés lors d’une infection antérieure.
Il pourrait être important de susciter des réponses plus robustes en anticorps et en lymphocytes T CD8+ contre les épitopes non-S pendant la vaccination, car il existe probablement des cibles de l’immunité non-S qui favorisent la résolution des infections et qui peuvent assurer une large immunité contre les variantes du SRAS-CoV- 2.
Une question centrale liée à l’immunité contre le SRAS-CoV-2 est de savoir si l’infection établit un réservoir de cellules mémoire contre cet agent pathogène, capables de se défendre contre une infection ultérieure.
Cette étude est rassurante, car la plupart des personnes infectées six mois plus tôt, même si elles n’ont présenté aucun symptôme ou des symptômes légers au cours de l’infection, ont pu développer une réponse immunitaire cellulaire contre cet agent pathogène.
Cependant, une hétérogénéité significative dans la réponse des lymphocytes T a été observée et les études futures devront donc définir si la réponse précoce des lymphocytes T prédit la qualité des anticorps provoqués par l’infection et quels facteurs de l’hôte ou variables virales autres que la gravité initiale de la maladie prédisent l’ampleur, la qualité. et/ou durabilité de l’immunité contre le SRAS-CoV-2. À partir de là, nous pouvons développer une compréhension des corrélats immunitaires de protection contre les résultats cliniques à long terme tels que le syndrome post-aigu du COVID et/ou la réinfection, même avec les variantes du SRAS-CoV-2 (Fig. 1) .
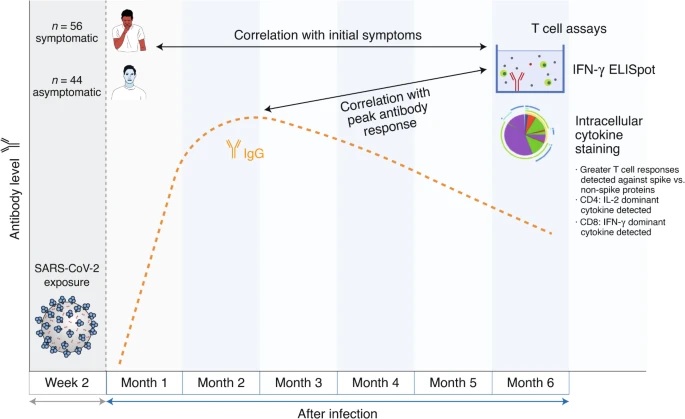
Zuo et coll. mesuré les réponses des lymphocytes T spécifiques au SRAS-CoV-2 chez 100 individus six mois après l’infection. Les réponses des lymphocytes T spécifiques du SRAS-CoV-2 ont été mesurées par coloration IFN-γ ELISpot et cytokine intracellulaire et corrélées aux symptômes initiaux et à la réponse maximale en anticorps.
















