1. Le virus
Le SRAS-CoV-2 contient plus de 30 000 bases d’ARN. Un mécanisme de relecture empêche ce vaste génome d’accumuler des mutations fréquentes. La grande protéine Spike (S) forme une sorte de couronne à la surface des particules virales. Son domaine de liaison aux récepteurs interagit avec une haute affinité avec les récepteurs de l’enzyme de conversion de l’angiotensine 2 (ACE2) à la surface des cellules hôtes.
Après la fixation, deux protéases de la cellule hôte (Furin et TMPRLRS) clivent les protéines de pointe et leurs peptides de fusion exposés fusionnent la membrane virale avec la membrane de la cellule hôte. L’ARN du virus pénètre dans les cellules des voies respiratoires supérieures et inférieures et est traduit en protéines virales. D’autres points d’entrée sont à l’étude. La cellule meurt , libérant des millions de nouveaux virus qui infectent d’autres cellules et d’autres individus [1] .
2. L’infection
Le SRAS-CoV-2 se propage de plusieurs manières. L’infection commence par une compétition entre les virions du SRAS-CoV-2 qui ont atteint la muqueuse respiratoire qui exprime des niveaux élevés de récepteurs ACE2 et la barrière créée par le mucus sécrété par les cellules caliciformes et déplacé par les cils ressemblant à des cheveux et par des réactions immunitaires. inné.
Il existe des preuves de la présence du virus dans des cellules autres que les épithéliums respiratoires, notamment les cellules épithéliales gastro-intestinales, les cellules endothéliales et les cellules myéloïdes. Nous ne savons pas encore combien de SARS-CoV-2 sont éliminés ; Cependant, l’efficacité des premières réponses de défense détermine si l’infection sera bénigne ou aura des conséquences graves.
La figure 1 montre les déterminants sélectifs de la susceptibilité au COVID-19, notamment la charge virale, le vieillissement, le mode de vie et éventuellement la génétique. Si les virions du SRAS-CoV-2 commencent à se répliquer, ils peuvent atteindre et détruire les cellules des alvéoles pulmonaires et du tractus gastro-intestinal. Une réaction immunitaire excessive ( tempête de cytokines ) peut augmenter les lésions tissulaires [2, 3] Figure 1 : Une représentation schématique de la pathogenèse du COVID-19. ACE2, enzyme de conversion de l’angiotensine 2, récepteurs Toll-TLR, M ? macrophages, cellules dendritiques DC, interféron IFN, interféron flèche faible IFN faible, syndrome de détresse respiratoire aiguë SDRA, les points indiquent que davantage de récepteurs sont impliqués (par exemple CD147 pour l’entrée virale).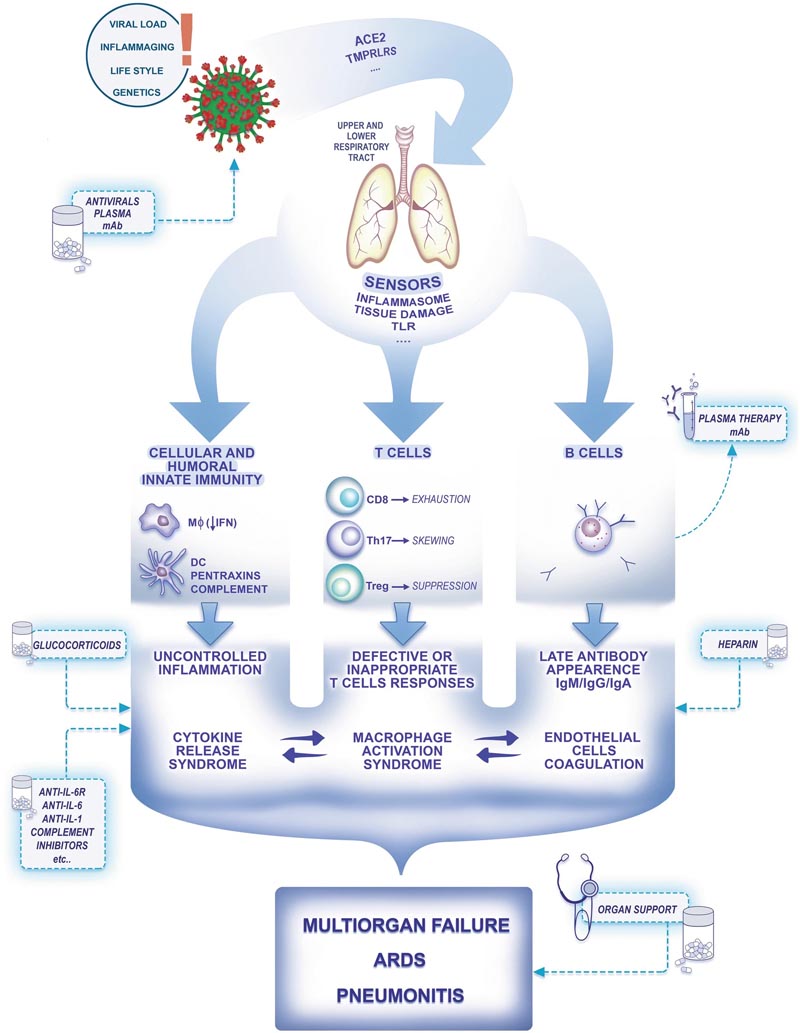
3. Immunité
L’immunité cellulaire et humorale innée représente une première ligne de résistance responsable de la majorité des rencontres avec des agents infectieux. Les preuves du SRAS-CoV-1 suggèrent que ces virus pourraient bloquer l’immunité antivirale médiée par l’interféron (Fig. 1). Les lymphocytes T CD8 cytotoxiques jouent un rôle essentiel dans la résistance aux antiviraux.
Les preuves suggèrent que pendant le COVID19, les lymphocytes T subissent un épuisement fonctionnel accompagné d’une lymphopénie , s’orientant vers un phénotype Th17, inapproprié pour l’immunité et la suppression antivirales (Fig. 1) [4] . La production d’anticorps intervient tardivement après l’exposition (jusqu’à 20 jours) et après l’apparition des symptômes (jusqu’à 15 jours pour 100 % des patients avec un score positif) [5] .
Il est intéressant de noter que les anticorps IgA sont présents dans le sang et la salive et pourraient jouer un rôle clé dans l’immunité. Il existe des preuves que les cas symptomatiques de COVID-19 provoquent une mémoire immunologique et une résistance à la réinfection . Selon le SRAS, la mémoire immunologique peut durer 2 à 3 ans , un aspect clé de l’immunité qu’il convient de définir.
4. Inflammations
L’inflammation joue un rôle clé dans le développement du COVID-19 à partir de l’infection par le SRAS-CoV-2. Les capteurs d’infection virale et de dommages cellulaires (par exemple, les inflammasomes ; TLR) déclenchent la production de cytokines inflammatoires dépendante des cellules myéloïdes (par exemple, IL-1 ; IL-6 ; chimiokines). Les macrophages et les cytokines inflammatoires amplifient l’inflammation locale et systémique et sont les principaux responsables de la défaillance d’un organe (Fig. 1).
Bien que le rôle de l’inflammation dans le COVID-19 soit évident, il n’est pas clair si la modulation de la réponse inflammatoire avec des médicaments pourrait apporter des bénéfices. Plusieurs médicaments sont actuellement à l’étude.
5. Thrombose
Comme on pouvait s’y attendre pour une maladie caractérisée par un état inflammatoire en réponse à une infection virale, les complications thromboemboliques veineuses et artérielles sont fréquentes chez les patients hospitalisés [6] . Des microthrombus sont présents dans les poumons et des altérations de la cascade de coagulation peuvent être mesurées au niveau systémique. Le dysfonctionnement endothélial provoqué à la fois par l’effet cytopathique direct du virus et par la réaction inflammatoire conduit à un environnement pro-thrombotique [3, 7] .
Chez les patients hospitalisés, le seuil de détection des complications thromboemboliques doit être bas. D’autre part, des recherches supplémentaires sont nécessaires pour examiner le rôle des schémas anticoagulants par rapport à la thromboprophylaxie standard dans le traitement de ces patients [8] .
6. Tests diagnostiques
La pierre angulaire des tests de diagnostic est actuellement l’évaluation de l’ARN viral dans des échantillons de lavage nasal ou broncho-alvéolaire par RT-PCR. La RT-PCR sur écouvillon représente un goulot d’étranglement et nous espérons que les tests basés sur la salive répondront au besoin urgent de tests généralisés.
Plus de 100 tests sérologiques ont été développés dans l’industrie ou dans des établissements universitaires, dont beaucoup sont mal caractérisés. Compte tenu du moment et des caractéristiques de la réponse anticorps, des tests correctement validés sont essentiels pour les études épidémiologiques, l’évaluation des dons de plasma, l’évaluation de la mémoire et de la réponse vaccinale, ainsi que comme diagnostic complémentaire chez les patients RT-PCR négatifs.
Aucune donnée disponible ne montre qu’un certain niveau d’anticorps est associé à une protection contre une exposition ultérieure au SRAS-CoV-2. Il n’y a donc aucune raison d’avoir des « passeports d’immunité » ou des « licences d’immunité » . Une fausse perception d’être « immunisé » peut encourager un comportement irresponsable [9] .
7. Aspects cliniques
L’infection par le SRAS-CoV-2 présente une variété de symptômes : elle peut être complètement asymptomatique ou présenter des symptômes graves. La période d’incubation du SRAS-CoV-2 est de 5,1 (4,5-5,8) jours [10] . La prévalence du dysfonctionnement d’un organe varie. Le SDRA a été signalé entre 3,4 % et plus de 10 % des cas positifs [3, 11, 12].
En Italie, alors que le pays a l’incidence quotidienne la plus élevée de nouveaux cas, environ 67 % des patients ont présenté des symptômes légers et environ 30 % ont présenté des symptômes nécessitant une hospitalisation. Les symptômes les plus courants sont la fièvre et la toux . Un petit pourcentage de cas signalent des symptômes gastro-intestinaux avant l’apparition des symptômes respiratoires.
Les patients plus âgés présentant des comorbidités sont plus susceptibles d’être gravement touchés et de mourir. La raison la plus courante d’admission en soins intensifs est l’insuffisance respiratoire aiguë . De nombreux patients ont développé un SDRA sévère. L’implication d’autres organes est souvent présente.
8. Thérapie
Les piliers du traitement sont la thérapie de soutien, l’assistance respiratoire et la gestion de la défaillance d’un organe. Il n’existe actuellement aucun traitement spécifique pour le SRAS-CoV-2 [13] . La chloroquine et l’hydroxychloroquine ont été largement utilisées ; Cependant, de plus en plus de preuves apparaissent concernant son manque d’efficacité et ses risques potentiels .
Des études évaluent actuellement le rôle des antiviraux, des stéroïdes et des thérapies immunomodulatrices . De nouvelles données probantes sur l’incidence élevée des complications thromboemboliques artérielles et veineuses donnent à l’héparine un rôle potentiel dans la prévention de ces événements.
Le plasma de patients guéris a été utilisé en Chine et ailleurs, notamment en Italie, comme source d’anticorps, comme cela a été fait pour le SRAS et le MERS. Sa sécurité et son efficacité dans cette maladie ont actuellement été étudiées.
9. Vaccins anti-SRAS-CoV-2
Comme on ne sait toujours pas si la protection contre le COVID-19 repose sur l’action des anticorps ou sur l’activité des cellules T, la mise en œuvre d’environ 150 programmes de développement de vaccins basés sur différentes plateformes technologiques est pleinement justifiée [ 14] .
Pour vérifier l’efficacité du vaccin dans le cadre des « règles d’utilisation d’urgence » , il a été proposé de vacciner des volontaires humains puis de les provoquer intentionnellement. L’OMS propose de prioriser l’efficacité des vaccins les plus prometteurs dans des études coordonnées. Dans un premier temps, il ne sera peut-être pas physiquement possible de produire suffisamment de vaccins pour la population mondiale. Cependant, l’OMS s’efforce de garantir qu’ils soient partagés équitablement, un défi crucial.
10. Préparation et recherches complémentaires
Si une chose ressort clairement des nombreux décès dus à cette pandémie, c’est que le monde n’était pas préparé d’un point de vue structurel, politique, clinique et de recherche.
Plusieurs agents de santé ont perdu la vie. Il s’agit d’une perte très grave qu’aucun pays ne peut se permettre de répéter.
Les deux principes clés qui doivent être suivis pour contrôler une éventuelle augmentation du nombre de patients malades sont d’augmenter la capacité d’intervention et, plus important encore, de contenir la transmission communautaire du virus .
Lors d’un cluster non contrôlé, le volume de patients nécessitant une admission en soins intensifs peut être très élevé et des efforts doivent être faits pour l’augmenter tout en garantissant la sécurité des patients non-COVID-19 et des travailleurs de la santé [15, 16] .
Un large éventail d’approches thérapeutiques ont été testées dans des conditions incontrôlées. Aujourd’hui, comme jamais auparavant, nous avons désespérément besoin de retrouver les concepts de médecine de précision qui ont mis des décennies à se développer.
Nous devons poursuivre nos efforts pour apporter le bon traitement au bon patient, au bon moment. Nous ne devrions pas chercher une « solution miracle », mais nous devrions saluer les efforts visant à répondre aux questions de recherche, et si la réponse amène de nouvelles questions, nous devrions les féliciter encore plus.
L’essai SOLIDARITÉ DE L’OMS ou REMAP-CAP, un essai conçu de manière adaptative, est un moyen prometteur de répondre à certaines de ces questions de recherche [17] .
Photo de Javier Matheu sur Unsplash