Résumé Depuis l’apparition de la maladie à coronavirus 2019 (COVID-19), les médecins ont déployé tous leurs efforts pour comprendre la maladie et un bref portrait de ses caractéristiques cliniques a été identifié. Dans la pratique clinique, nous avons noté que de nombreux patients atteints de COVID-19 dans un état grave ou critique ont développé des manifestations cliniques typiques de choc , notamment des extrémités froides et des pouls périphériques faibles, même en l’absence d’hypotension manifeste. Comprendre le mécanisme du sepsis viral dans le COVID-19 est la garantie d’explorer de meilleurs soins cliniques pour ces patients. Avec les preuves recueillies lors d’études d’autopsie sur le COVID-19 et de recherches scientifiques fondamentales sur le coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) et le SRAS-CoV, nous avons avancé plusieurs hypothèses sur la pathogenèse du SRAS-CoV. -2 après plusieurs cycles de discussions entre chercheurs en sciences fondamentales, pathologistes et cliniciens travaillant sur le COVID-19. Nous émettons l’hypothèse qu’un processus appelé sepsie virale est crucial pour le mécanisme pathologique du COVID-19. Bien que ces idées puissent s’avérer imparfaites, voire incorrectes, par la suite, nous pensons qu’elles peuvent fournir une contribution et une orientation à la recherche fondamentale à l’heure actuelle. |
L’épidémie du coronavirus 2 (SARS-CoV-2) du syndrome respiratoire aigu sévère, signalée pour la première fois à Wuhan, en Chine, en décembre 2019, a eu un impact énorme sur la Chine et le monde entier. La maladie causée par le SRAS-CoV-2 est appelée maladie à coronavirus 2019 (COVID-19). Le 19 mars 2020, le nombre de cas confirmés était passé à plus de 200 000. Bien que la plupart des patients infectés par le SRAS-CoV-2 présentaient une maladie bénigne, environ 5 % des patients présentaient des lésions pulmonaires graves, voire un dysfonctionnement de plusieurs organes , entraînant un taux de mortalité de 1,4 %1.
En pratique, nous avons noté que de nombreux patients atteints de COVID-19 dans un état grave ou critique ont développé des manifestations cliniques typiques de choc, notamment des extrémités froides et des pouls périphériques faibles, même en l’absence d’hypotension manifeste. Beaucoup de ces patients présentaient une acidose métabolique sévère , indiquant un possible dysfonctionnement de la microcirculation. De plus, certains patients souffraient d’insuffisance hépatique2 et rénale en plus de lésions pulmonaires graves.
Ces patients répondaient aux critères diagnostiques de sepsis et de choc septique selon le consensus international Sepsis-3 3, mais l’infection par le SRAS-CoV-2 semblait être la seule cause chez la plupart d’entre eux.1 Des cultures d’échantillons de sang et des voies respiratoires inférieures ont été réalisées. s’est révélé négatif pour les bactéries et les champignons chez 76 % des patients atteints de sepsis dans une cohorte COVID-19.
Par conséquent, le sepsis viral serait plus précis pour décrire les manifestations cliniques des patients atteints de COVID-19 sévères ou critiques.5 Comprendre le mécanisme du sepsis viral dans le COVID-19 est la garantie d’explorer de meilleurs soins cliniques pour ces patients.
Infection virale et pathogenèse du COVID-19 dans les organes
Dans les études de biopsie ou d’autopsie, la pathologie pulmonaire des patients atteints de COVID-19 en phase précoce6 et tardive7 a montré des lésions alvéolaires diffuses avec formation de membranes hyalines, de cellules mononucléées et de macrophages infiltrant les espaces aériens, et un épaississement diffus de la paroi alvéolaire. Des particules virales ont été observées dans les cellules épithéliales alvéolaires bronchiques de type 2 par microscopie électronique8, 9.
De plus, une atrophie de la rate, une nécrose des ganglions lymphatiques hilaires, une hémorragie focale dans le rein, une hypertrophie du foie avec infiltration de cellules inflammatoires, un œdème et une dégénérescence dispersée des neurones dans le cerveau étaient présents chez certains patients 8, 9.
Des particules infectieuses du virus SRAS-CoV-2 ont été isolées à partir d’échantillons respiratoires10, ainsi que d’échantillons fécaux11 et d’urine (Zhao J, Université médicale de Guangzhou, communication personnelle) de patients atteints de COVID-19, ce qui suggère un dysfonctionnement Des dommages à plusieurs organes dans les cas graves de COVID19 est au moins partiellement causée par une attaque directe du virus. Cependant, il n’existe actuellement aucun rapport sur les observations post-mortem de la dissémination généralisée de particules virales par autopsie.
Si le SRAS-CoV-2 peut cibler directement des organes autres que les poumons, en particulier les organes avec une expression élevée de l’enzyme de conversion de l’angiotensine 2 (ACE2) 12,13 et les organes avec L-SIGN(14) comme récepteurs cellulaires alternatifs possibles pour le SRAS- CoV-2, il doit être étudié plus en détail. Par ailleurs, la question de savoir comment le SRAS-CoV-2 se propage aux organes extra-pulmonaires reste une énigme. Une variation génomique du SRAS-CoV-2 en circulation a été observée, et la différence de virulence nécessite des recherches plus approfondies15.
Réponse immunitaire au SRAS-CoV-2 et à la septicémie virale
Il a été démontré que les cytokines et les chimiokines pro-inflammatoires comprennent le facteur de nécrose tumorale (TNF) α, l’interleukine 1β (IL-1β), l’IL-6, le facteur de stimulation des colonies de granulocytes, la protéine 10 induite par l’interféron gamma, la protéine chimioattractante. Protéines inflammatoires des monocytes et des macrophages 1. -α étaient significativement élevés chez les patients atteints de COVID-19, 16, 17. Comme dans le cas d’une infection grippale grave, la tempête de cytokines pourrait jouer un rôle important dans l’immunopathologie du COVID-19. .
Des études antérieures ont révélé que les cellules épithéliales pulmonaires, les macrophages et les cellules dendritiques expriment toutes des cytokines dans une certaine mesure au cours de l’infection grippale par l’activation de récepteurs de reconnaissance de formes (y compris les récepteurs Toll-like TLR3, TLR7 et TLR8), le gène I inductible par l’acide rétinoïque et ses membres. de la famille des récepteurs de type NOD18.
Cependant, on sait peu de choses sur la situation du COVID-19 à l’heure actuelle. Il est crucial d’identifier la source principale de la tempête de cytokines en réponse à l’infection par le SRAS-CoV-2 et les mécanismes virologiques à l’origine de la tempête de cytokines. Il serait également pertinent d’élucider la cinétique d’activation des cytokines lors de l’infection par le SARS-CoV-2 : quand les premières cytokines ont-elles été libérées et quelles étaient-elles ?
En outre, il reste à déterminer si les lésions tissulaires directement induites par le virus, la tempête systémique de cytokines ou les effets synergiques des deux contribuent au dysfonctionnement multi-organique des patients atteints de formes graves de COVID-19.
De plus, il convient de surveiller si le blocage de l’un de ces médiateurs pro-inflammatoires affecterait le résultat clinique. Des anticorps monoclonaux anti-IL-6R ou des corticostéroïdes ont été proposés pour atténuer la réponse inflammatoire.
Cependant, l’IL-6 pourrait jouer un rôle important dans le déclenchement d’une réponse préliminaire contre l’infection virale en favorisant la clairance virale médiée par les neutrophiles, car une étude a révélé qu’un déficit en IL-6 ou en IL-6R conduisait à la persistance de l’infection grippale et finalement à la mort. chez la souris.19 Et l’utilisation de corticostéroïdes reste controversée20, 21.
Cependant, la réponse immunitaire dérégulée présente également une étape de suppression immunitaire après la phase pro-inflammatoire. Elle se caractérise par une réduction soutenue et substantielle du nombre de lymphocytes périphériques, principalement des lymphocytes T CD4 et CD8 chez les patients atteints de COVID-19, et est associée à un risque élevé de développer une infection bactérienne secondaire. Cette affection, connue sous le nom de lymphopénie , a également été observée dans des cas de grippe grave et d’autres infections virales respiratoires.
Il a été démontré que le degré de lymphopénie est en corrélation avec la gravité de la COVID-19.17
Le mécanisme sous-jacent à la lymphopénie reste inconnu. Des études antérieures ont montré que des particules virales de type SRAS et de l’ARN du SRAS-CoV ont été détectées dans des lymphocytes T isolés d’échantillons de sang périphérique, de rate, de ganglions lymphatiques et de tissu lymphoïde provenant de divers organes 22,23, ce qui suggère que le SRAS-CoV pourrait infecter T. cellules directement . Les domaines de liaison aux récepteurs des protéines de pointe entre le SRAS-CoV-2 et le SRAS-CoV présentent un degré élevé de cohérence24.25 et l’ARN du SRAS-CoV-2 a également été détecté dans des échantillons de sang16.
Par conséquent, il est raisonnable de supposer qu’en plus de la mort cellulaire induite par l’activation induite par l’interaction du Fas et du ligand Fas, ainsi que de l’axe du ligand induisant l’apoptose lié au TNF, 26 le
SRAS-CoV-2 pourrait infecter directement les lymphocytes . en particulier les lymphocytes T, et déclenchent ou favorisent la mort des cellules lymphocytaires, conduisant finalement à une lymphopénie et à une altération des réponses antivirales. Cependant, une telle hypothèse mérite d’être approfondie.
Il faut également identifier quels types de mort cellulaire se produisent dans les lymphocytes après une infection par le SRAS-CoV-2. En outre, il est intrigant que les lymphocytes manquent d’expression de l’ACE2, ce qui suggère un mécanisme alternatif par lequel le SRAS-CoV-2 engage les lymphocytes T.13 La question de savoir si les macrophages alvéolaires peuvent phagocyter les particules virales puis les transférer aux lymphocytes est une question ouverte dans ce domaine.
COVID-19 et coagulation anormale
Des études ont révélé que 71,4 % des non-survivants du COVID-19 ont atteint le grade de coagulation intravasculaire disséminée ouverte (≥5 points selon les critères de la Société internationale sur la thrombose et l’hémostase)27 et ont présenté des résultats de coagulation anormaux au cours des étapes. plus tard de la maladie ; Des concentrations particulièrement élevées de D-dimères et d’autres produits de dégradation de la fibrine étaient significativement associées à un mauvais pronostic4.
Cependant, les mécanismes spécifiques de la coagulopathie n’ont pas encore été identifiés.
Il reste à déterminer si le SRAS-CoV-2 est capable d’attaquer directement les cellules endothéliales vasculaires qui expriment des niveaux élevés d’ACE2,13 et de conduire ensuite à une coagulation anormale et à une septicémie.
Pendant ce temps, ACE2 est également un important régulateur de la pression artérielle . Une expression élevée de l’ACE2 dans le système circulatoire après une infection par le SRAS-CoV-2 pourrait partiellement contribuer à l’hypotension septique .
Des questions ont été soulevées concernant l’utilisation d’ un bloqueur des récepteurs de l’angiotensine II (ARA) et d’un traitement par inhibiteur de l’ECA pour les patients souffrant d’hypertension artérielle liée au COVID-19.
Certains chercheurs ont suggéré que les inhibiteurs de l’ECA pourraient bénéficier à ces patients en réduisant l’inflammation pulmonaire 29, tandis que d’autres ont soutenu que les inhibiteurs de l’ECA pourraient améliorer l’entrée du virus en régulant les niveaux de l’ECA 230. Cependant, il existe peu de preuves cliniques sur le risque de traiter les patients atteints de COVID-19 avec l’ARB. ou des inhibiteurs de l’ECA. Des recherches supplémentaires sont nécessaires pour déterminer si ces médicaments inhibent ou facilitent l’entrée du virus.
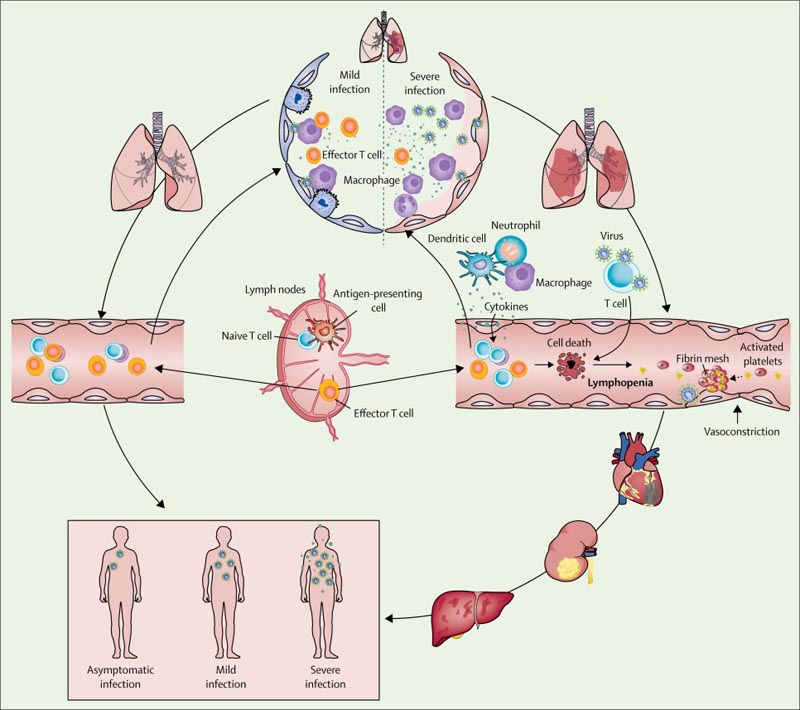 Figure Occurrence et évolution du syndrome respiratoire aigu sévère coronavirus 2 sepsis viral
Figure Occurrence et évolution du syndrome respiratoire aigu sévère coronavirus 2 sepsis viral
Conclusions
Sur la base d’observations de patients atteints de COVID-19, nous avons émis l’hypothèse que, dans les cas bénins , les macrophages résidents qui déclenchent des réponses inflammatoires pulmonaires étaient capables de contenir le virus après une infection par le SRAS-CoV-2 ; Des réponses immunitaires innées et adaptatives ont été efficacement établies pour freiner la réplication virale afin que le patient se rétablisse rapidement.
Cependant, dans les cas graves ou critiques de COVID-19, l’intégrité de la barrière épithéliale-endothéliale (air-sang) a été gravement perturbée. En plus des cellules épithéliales, le SRAS-CoV-2 peut également attaquer les cellules endothéliales capillaires pulmonaires, entraînant l’exsudat d’une grande quantité de composants plasmatiques dans la cavité alvéolaire.
En réponse à l’infection par le SRAS-CoV-2, les macrophages alvéolaires ou les cellules épithéliales pourraient produire diverses cytokines et chimiokines proinflammatoires. Suite à ce changement, les monocytes et les neutrophiles étaient chimiotactiques au niveau du site d’infection pour éliminer ces exsudats contenant des particules virales et des cellules infectées, entraînant une inflammation incontrôlée .
Dans ce processus, en raison de la réduction substantielle et du dysfonctionnement des lymphocytes, la réponse immunitaire adaptative ne peut pas être initiée efficacement. Une infection virale non contrôlée entraîne une infiltration accrue de macrophages et une aggravation des lésions pulmonaires.
Pendant ce temps, l’attaque directe d’autres organes par le SRAS-CoV-2 disséminé, la pathogenèse immunitaire provoquée par une tempête systémique de cytokines et les dysfonctionnements de la microcirculation conduisent ensemble à une septicémie virale . Par conséquent, un traitement antiviral efficace et des mesures visant à moduler la réponse immunitaire innée et à restaurer la réponse immunitaire adaptative sont essentiels pour briser le cercle vicieux et améliorer les résultats pour les patients.
Depuis l’apparition de la COVID-19, les médecins ont fait de leur mieux pour comprendre la maladie et un bref portrait de ses caractéristiques cliniques a été dressé. Cependant, des questions restent ouvertes sur les mécanismes des observations.
Grâce aux preuves recueillies lors d’études d’autopsie sur le COVID-19 et de recherches scientifiques fondamentales sur le SRAS-CoV-2 et le SRAS-CoV, nous avons avancé plusieurs hypothèses sur la pathogenèse du SRAS-CoV-2 après plusieurs cycles de discussions entre chercheurs. des sciences fondamentales, des pathologistes et des cliniciens travaillant sur le COVID-19.
Nous émettons l’hypothèse qu’un processus appelé sepsie virale est crucial pour le mécanisme pathologique du COVID-19. Même si ces idées pourraient s’avérer imparfaites, voire incorrectes, par la suite, nous pensons qu’elles soulèvent des questions pour les recherches futures.
- De futures recherches scientifiques sont nécessaires pour déterminer si le SRAS-CoV-2 attaque directement les cellules endothéliales vasculaires et pour examiner l’effet du SRAS-CoV-2 sur la coagulation et la dissémination du virus.
- Des essais cliniques et des expérimentations animales doivent être réalisés pour évaluer l’effet des inhibiteurs de l’ARB et de l’ECA sur l’issue de l’infection par le SRAS-CoV-2 in vivo.
- Des efforts devraient être faits pour confirmer si le SRAS-CoV-2 infecte directement les lymphocytes et comment il influence la réponse immunitaire adaptative.
- La cinétique de la réponse des cytokines au cours de l’infection par le SRAS-CoV-2 doit également faire l’objet d’études plus approfondies.
- L’efficacité des thérapies immunomodulatrices doit être évaluée dans le cadre d’essais cliniques randomisés.