Hintergrund
Der Konsum alkoholischer Getränke ist so alt wie die Menschheitsgeschichte und reicht bis in frühe Zivilisationen wie das alte Ägypten und das alte China zurück. Die Destillation von Alkohol kann den frühen Wissenschaftlern der islamischen Welt zugeschrieben werden. Alkoholische Getränke, die Ethanol enthalten, gehören weltweit zu den am häufigsten konsumierten und akzeptierten Freizeitdrogen. Übermäßiger Konsum alkoholischer Getränke hat negative medizinische und soziale Folgen.
Allerdings können manche Menschen unter diesen Folgen leiden, ohne Alkohol zu konsumieren.
Diese unglücklichen Menschen leiden am sogenannten Darmfermentationssyndrom (GFS), auch bekannt als endogenes alkoholisches Fermentationssyndrom, Darmfermentationssyndrom oder Selbstbrauer-Syndrom . Wir schlagen vor, diese Krankheit in der zukünftigen Literatur als intestinales Fermentationssyndrom zu bezeichnen.
GFS ist eine seltene und wenig bekannte Erkrankung. Verzehrte Kohlenhydrate werden im Magen-Darm-Trakt von Pilzen und/oder Bakterien zu Alkohol verstoffwechselt. Pilze kommen im oberen Gastrointestinaltrakt nicht häufig vor, können aber im Dickdarm als Teil des kommensalen Mikrobioms vorkommen.
Es ist bekannt, dass einige Pilze Ethanol produzieren, beispielsweise Pilze der Gattungen Candida und Saccharomyces. Kürzlich wurde auch die Rolle von Bakterien wie Klebsiella und Escherichia bei der Alkoholproduktion im Darm deutlich.
Es handelt sich um eine seltene und unterdiagnostizierte Erkrankung, bei der aufgenommene Kohlenhydrate durch die Mikrobiota im Magen-Darm-Trakt oder im Harntrakt in Alkohol umgewandelt werden.
GFS-Symptome können schwerwiegende Auswirkungen auf das Wohlbefinden der Patienten haben und soziale und rechtliche Konsequenzen haben.
Das Ziel dieser systematischen Überprüfung bestand darin, den Nachweis von FSGS, verursachenden Mikroorganismen, Diagnosen und möglichen Behandlungen zu bewerten.
Methoden
Vor Beginn der systematischen Überprüfung wurde ein Protokoll entwickelt (PROSPERO 207182).
Wir haben am 1. September 2020 eine Literaturrecherche nach klinischen Studien mit PubMed und Embase durchgeführt. Alle klinischen Studien, einschließlich Fallberichte, die FSGS beschreiben, wurden einbezogen.
Ergebnisse
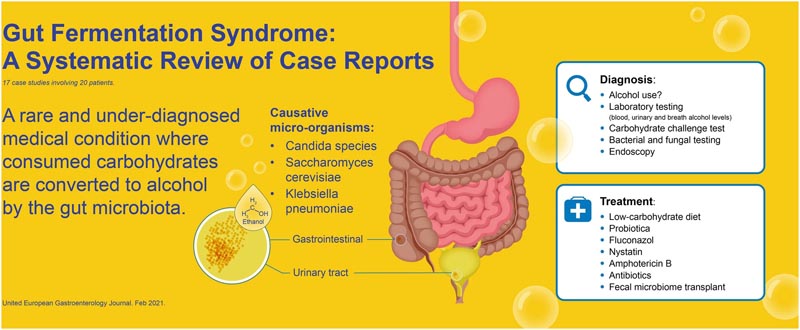
Insgesamt wurden 17 Fallberichte einbezogen, darunter 20 Patienten mit der Diagnose FSGS. Zu den Arten, die GFS verursachen, gehörten Klebsiella pneumoniae, Candida albicans, C. glabrata, Saccharomyces cerevisiae, C. intermedia, C. parapsilosis und C. kefyr.

Überblick über das intestinale Fermentationssyndrom. Die hervorgehobenen Mikroorganismen wurden in den Fallberichten nicht beschrieben, sind aber in der Literatur für ihre Fähigkeit zur Ethanolproduktion bekannt.
Klinische Merkmale
Die in den eingeschlossenen Fallberichten beschriebenen Patienten hatten zum Zeitpunkt der Vorstellung verschiedene Anfangssymptome. Zu diesen Symptomen gehören: Schwierigkeiten beim Sprechen (n = 5), fruchtiger Atemgeruch (n = 3), Schwierigkeiten beim Gehen (n = 5), depressive Episoden (n = 2), Krampfanfälle (n = 2), Erbrechen (n = 4). ), Rauschgefühl (n = 7) und Orientierungslosigkeit (n = 3).
In zwei Fällen waren die Leberfunktionswerte erhöht. Bei Alkoholtests kamen zwei Fallberichte ans Licht , einer davon nach einem Unfall. Bei acht Fällen bestand zunächst der Verdacht auf GAS als Hauptarbeitsdiagnose.
Das Durchschnittsalter der Patienten betrug 44 Jahre (Bereich: 3–71) und 14 Patienten waren Männer (70 %). In 11 der 20 Fallberichte wiesen die Patienten Komorbiditäten auf. Zu den Komorbiditäten gehörten Kurzdarmsyndrom (n = 3), Typ-Diabetes mellitus (n = 4), Bluthochdruck (n = 3), Leberzirrhose (n = 1) und Morbus Crohn (n = 1).
Kruckenberg et al.14 beschrieben einen Patienten, der an FSGS im Urin litt . Diese FSGS-Variante wurde durch chronische Glykosurie und die Besiedlung der Harnwege durch C. glabrata und S. cerevisiae verursacht. Dieser Patient war aufgrund einer anhaltenden Glykosurie schwer zu behandeln.
Als weitere Komorbidität wird das Kurzdarmsyndrom beschrieben. Eine Stagnation der verdauten Nahrung im Kurzdarm kann günstige Bedingungen für das Wachstum von Pilzen und Bakterien schaffen.
Neuere Studien fanden auch Veränderungen im Zusammenhang mit der Roux-en-Y-Magenbypass-Operation.
Diagnostische Bewertung
Die vollständige Beurteilung des FSGS umfasst eine Anamnese, eine körperliche Untersuchung, Labortests, eine Stuhlprobe mit Kultur, einen Kohlenhydrat-Challenge-Test und eine Endoskopie mit Biopsien für die Kultur.
Die Beurteilung der Patienten sollte eine vollständige Anamnese umfassen, einschließlich Antibiotikagebrauch, Alkoholkonsum und ungeklärter Vergiftungsepisoden. Auf eine neurologische Untersuchung hätte eine allgemeine körperliche Untersuchung folgen sollen. Bei der Untersuchung sollte besonderes Augenmerk auf Anzeichen von Leberanomalien (z. B. Lebervergrößerung, Gelbsucht, Spinnennävi) und neurologische Defizite (z. B. undeutliche Sprache und Schwierigkeiten beim Gehen) gelegt werden, die auf eine Vergiftung zurückzuführen sind. Alkohol.
Zu den Labortests gehören ein großes Blutbild, Elektrolyte (Natrium, Kalium), Nierenfunktionstests (Kreatinin, Blut-Harnstoff-Stickstoff), Leberfunktionstests (Alaninaminotransferase, alkalische Phosphatase, Bilirubin) und endokrine Funktionen (Glukose, blutstimulierendes Hormon). Schilddrüse) und Vitaminstatus (insbesondere Vitamin B1 und B12).
Ein Stuhltest kann zum Nachweis von Pilz- oder Bakterienwachstum eingesetzt werden. Zur Diagnose von FSGS ist eine Kohlenhydratbelastung von 100 bis 200 g Glukose in Kombination mit einer Blutalkoholkonzentration (BAC) und einem Atem- oder Plasmaalkoholtest in Abständen von 0, 4, 8, 16 und 24 Stunden erforderlich. Die Messung sollte vor der Verabreichung von Glukose durchgeführt werden . Es ist wichtig, dass die Patienten während des Tests streng auf den Konsum von alkoholischen Getränken überwacht werden , da dieser ansonsten den Test stark verzerren würde.
Eine Endoskopie des oberen und unteren Gastrointestinaltrakts kann verwendet werden, um Magen-Darm-Sekrete und Biopsien für Pilz- und Bakterientests zu sammeln. Diese Pilze und Bakterien können auf ihre Empfindlichkeit gegenüber Antibiotika und Antimykotika getestet werden.
Die Diagnose FSGS kann gestellt werden, wenn der Kohlenhydrat-Challenge-Test positiv ausfällt, ein Erreger kultiviert wurde und alle anderen Ursachen der Symptome ausgeschlossen wurden.
Behandlungsmöglichkeiten
In fünf Fallberichten reichten Fluconazol 100 mg/Tag über 3 Wochen und/oder eine kohlenhydratarme Diät zur Behandlung von FSGS aus.
Allerdings musste bei einigen Patienten auf andere Medikamente umgestellt werden, da Fluconazol wirkungslos war. Zu diesen anderen Behandlungen gehörten Nystatin, Amphotericin, Micafungin, Itraconazol, Voriconazol, Metronidazol oder Kombinationen davon.
Fluconazol wurde in einigen Fällen empirisch zur Behandlung von FSGS eingesetzt; Idealer wäre es jedoch, Patienten auf der Grundlage von Antibiotika- und Antimykotika-Empfindlichkeitstests zu behandeln.
Darüber hinaus wurde in einer Studie die erfolgreiche Behandlung von FSGS mit einer fäkalen Mikrobiota-Transplantation (FMT) beschrieben, nachdem alle anderen Therapien versagt hatten.
Klinische Implikationen
Ärzte sollten sich dieser seltenen, aber unangenehmen Diagnose bewusst sein . Wie aus einigen Fallberichten hervorgeht, wurden die Patienten fälschlicherweise als Alkoholkonsumenten diagnostiziert. Einige erhielten sogar eine psychiatrische Behandlung zur Entgiftung, die jedoch erfolglos blieb.
Ärzte sollten besonders wachsam sein, wenn ein Patient zuvor mit Antibiotika behandelt wurde und Symptome einer Alkoholvergiftung zeigt, aber jegliche Anwendung ablehnt.
Dabei wird auch zwischen Patienten mit FSGS und Menschen mit übermäßigem Alkoholkonsum unterschieden. Bei Menschen, die zu viel Alkohol konsumierten, stieg der Ethanolspiegel nach der Kohlenhydratbelastung nicht an.
Fluconazol in Kombination mit einer kohlenhydratarmen Diät war in fünf Fallberichten wirksam; Einige Patienten benötigten jedoch eine zusätzliche antimykotische Behandlung. Die Entscheidung für eine antimykotische oder antibiotische Behandlung sollte auf der Grundlage des kultivierten Mikroorganismus erfolgen, vorzugsweise auf der Grundlage eines Empfindlichkeitstests.
Juristische Folgen
In zwei Fallberichten hatten ungewöhnlich hohe Ethanolspiegel im Blut rechtliche Konsequenzen für den Patienten. Übermäßiger Alkoholkonsum beim Autofahren ist weltweit gesetzlich verboten. Die rechtlichen Konsequenzen reichen von einer Geldstrafe bis hin zu einer Freiheitsstrafe, wenn der Tod bei einem Autounfall eingetreten ist. Bei Patienten mit GFS kann es zu einem Autounfall kommen oder bei einem routinemäßigen Atemalkoholtest werden hohe Ethanolwerte festgestellt, ohne dass sie Alkohol konsumieren.
Kürzlich wurde in den Niederlanden ein männlicher Patient, bei dem FSGS diagnostiziert wurde, von der Anklage freigesprochen, nachdem er einen Unfall verursacht hatte, während er durch körpereigenes Ethanol berauscht war, ohne Alkohol konsumiert zu haben. Dies unterstreicht die Bedeutung der Früherkennung dieser seltenen Erkrankung.
Dies ist in Rechtsfällen unbedingt zu berücksichtigen. Ärzte sollten Patienten mit ungeklärten Vergiftungsepisoden ernst nehmen, und das könnte verhindern, dass Patienten (tödliche) Autounfälle verursachen.
Schlussfolgerungen FSGS ist eine seltene und oft missverstandene und unerkannte Erkrankung, die Ärzte berücksichtigen oder sich darüber im Klaren sein sollten. Die Literatur besteht nur aus Fallberichten, es liegen keine hochgradig evidenzbasierten Studien zur Prävalenz und Behandlung vor. Die Krankheit wird hauptsächlich durch die Gattungen Saccharomyces und Candida verursacht und in einigen Fällen zuvor mit Antibiotika behandelt. In einigen Fallberichten wurden Risikofaktoren wie Diabetes mellitus, Leberzirrhose und frühere Darmoperationen identifiziert. Die Diagnose kann durch eine entsprechende Anamnese und einen Kohlenhydrat-Challenge-Test gestellt werden. Zu den aktuellen Behandlungen gehören Antimykotika, kohlenhydratarme Ernährung und Probiotika. Die Transplantation fäkaler Mikrobiota könnte eine potenzielle Rolle bei der Behandlung von FSGS spielen. Auch minderwertige FSGS sollten in NASH berücksichtigt und untersucht werden. |















