Le complicanze cardiovascolari stanno rapidamente emergendo come una minaccia chiave nella malattia da coronavirus 2019 (COVID-19) oltre alle malattie respiratorie. Tuttavia, i meccanismi alla base dell’effetto sproporzionato dell’infezione da sindrome respiratoria acuta grave da coronavirus 2 (SARS-CoV-2) in pazienti con comorbidità cardiovascolari rimangono ancora non completamente compresi. 2
SARS-CoV-2 infetta l’ospite utilizzando il recettore dell’enzima di conversione dell’angiotensina 2 (ACE2), che è espresso in diversi organi, inclusi polmoni, cuore, reni e intestino. I recettori ACE2 sono espressi anche dalle cellule endoteliali.
Al momento non è noto se i disturbi vascolari nel COVID-19 siano dovuti al coinvolgimento delle cellule endoteliali da parte del virus. È interessante notare che SARS-CoV-2 può infettare direttamente gli organoidi dei vasi sanguigni umani progettati in vitro.4
Qui dimostriamo il coinvolgimento delle cellule endoteliali attraverso i letti vascolari di diversi organi in una serie di pazienti COVID-19.
Il paziente 1 era un uomo di 71 anni sottoposto a trapianto di rene con malattia coronarica e ipertensione. Le condizioni del paziente sono peggiorate dopo la diagnosi di COVID-19 e ha richiesto ventilazione meccanica. Si è verificata un’insufficienza multiorgano e il paziente è morto il giorno 8.
L’analisi post mortem del rene trapiantato mediante microscopia elettronica ha rivelato strutture di inclusione virale nelle cellule endoteliali (Figura A, B). Nelle analisi istologiche, abbiamo riscontrato un accumulo di cellule infiammatorie associate all’endotelio, nonché di corpi apoptotici, nel cuore, nell’intestino tenue (figura C) e nei polmoni (figura D). Nel polmone è stato riscontrato un accumulo di cellule mononucleari e la maggior parte dei piccoli vasi polmonari appariva congestionata.
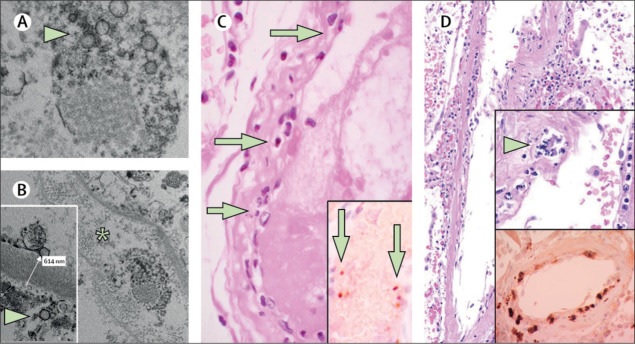
(A, B) La microscopia elettronica del tessuto renale mostra corpi di inclusione virale in uno spazio peritubulare e particelle virali nelle cellule endoteliali delle anse capillari glomerulari. Gli aggregati di particelle virali (freccia) appaiono con una superficie circolare densa e un centro chiaro. L’asterisco nel pannello B segna lo spazio peritubulare compatibile con il capillare contenente particelle virali. L’inserto nel pannello B mostra la membrana basale glomerulare con cellule endoteliali e una particella virale (freccia; circa 150 nm di diametro). (C) Campione di resezione dell’intestino tenue del paziente 3, colorato con ematossilina ed eosina. Le frecce indicano infiltrati di cellule mononucleari dominanti all’interno dell’intima lungo il lume di molti vasi. Il riquadro del pannello C mostra la colorazione immunoistochimica della caspasi 3 nei campioni di intestino tenue provenienti dalla sezione seriale del tessuto descritta nel pannello D. I modelli di colorazione erano coerenti con l’apoptosi delle cellule endoteliali e delle cellule mononucleari osservate nelle sezioni colorate con ematossilina-eosina, indicando che l’apoptosi è indotta in una percentuale sostanziale di queste cellule. (D) Il campione polmonare post mortem colorato con ematossilina ed eosina mostrava setti polmonari ispessiti, compreso un grande vaso arterioso con infiltrazione mononucleare e neutrofila (freccia nel riquadro superiore). Il riquadro inferiore mostra la colorazione immunoistochimica per la caspasi 3 nello stesso campione polmonare; Questi modelli di colorazione erano coerenti con l’apoptosi delle cellule endoteliali e delle cellule mononucleari osservate nelle sezioni colorate con ematossilina-eosina. COVID-19 = malattia da coronavirus 2019.
Il paziente 2 era una donna di 58 anni, affetta da diabete, ipertensione e obesità. Ha sviluppato un’insufficienza respiratoria progressiva dovuta a COVID-19 e successivamente ha sviluppato un’insufficienza multiorgano e ha richiesto una terapia sostitutiva renale.
Il giorno 16, l’ischemia mesenterica ha portato alla rimozione dell’intestino tenue necrotico. L’insufficienza circolatoria si è verificata nel contesto di insufficienza cardiaca destra secondaria a infarto miocardico con sopraslivellamento del tratto ST e l’arresto cardiaco ha provocato la morte.
L’esame istologico post-mortem ha rivelato un’endoteliite linfocitaria nel polmone, nel cuore, nei reni e nel fegato, nonché una necrosi delle cellule epatiche. Abbiamo trovato evidenza istologica di infarto miocardico ma nessun segno di miocardite linfocitaria. L’istologia dell’intestino tenue ha mostrato endoteliite (endotelio) dei vasi sottomucosi.
Il paziente 3 era un uomo di 69 anni, affetto da ipertensione che ha sviluppato insufficienza respiratoria a causa del COVID-19 e necessitava di ventilazione meccanica. L’ecocardiografia mostrava una ridotta frazione di eiezione ventricolare sinistra. Si è verificato un collasso circolatorio con ischemia mesenterica ed è stata eseguita la resezione dell’intestino tenue, ma il paziente è sopravvissuto. L’istologia della resezione dell’intestino tenue ha rivelato un’endotelite prominente dei vasi sottomucosi e dei corpi apoptotici (Figura C).
Abbiamo trovato prove di infezione virale diretta della cellula endoteliale e di infiammazione endoteliale diffusa. Sebbene il virus utilizzi il recettore ACE2 espresso dai pneumociti nel rivestimento epiteliale alveolare per infettare l’ospite, causando così lesioni polmonari, il recettore ACE2 è ampiamente espresso anche sulle cellule endoteliali, che attraversano più organi.3
Il reclutamento di cellule immunitarie, tramite infezione virale diretta dell’endotelio o mediato dal sistema immunitario, può portare a una diffusa disfunzione endoteliale associata all’apoptosi (Figura D). L’ endotelio vascolare è un organo paracrino, endocrino e autocrino attivo, essenziale per la regolazione del tono vascolare e il mantenimento dell’omeostasi vascolare.
La disfunzione endoteliale è un importante determinante della disfunzione microvascolare poiché sposta l’equilibrio vascolare verso un aumento della vasocostrizione con conseguente ischemia d’organo, infiammazione con edema tissutale associato e uno stato procoagulante .
I nostri risultati mostrano la presenza di elementi virali all’interno delle cellule endoteliali e un accumulo di cellule infiammatorie, con evidenza di morte delle cellule endoteliali e infiammatorie. Questi risultati suggeriscono che l’infezione da SARS-CoV-2 facilita l’induzione di endotelite in vari organi come conseguenza diretta del coinvolgimento virale (come osservato con la presenza di corpi virali) e della risposta infiammatoria dell’ospite.
Inoltre, l’induzione di apoptosi e piroptosi potrebbe svolgere un ruolo importante nel danno delle cellule endoteliali nei pazienti COVID-19. L’endotelite da COVID-19 potrebbe spiegare la funzione microcircolatoria sistemica in diversi letti vascolari e le sue sequele cliniche nei pazienti con COVID-19.
Questa ipotesi fornisce un razionale per le terapie volte a stabilizzare l’endotelio affrontando la replicazione virale, in particolare con farmaci antinfiammatori anti-citochine, ACE inibitori e statine 7, 8, 9, 10, 11.
Questa strategia potrebbe essere particolarmente rilevante per i pazienti vulnerabili con disfunzione endoteliale preesistente , associata a sesso maschile, fumo, ipertensione, diabete, obesità e malattie cardiovascolari accertate, tutti associati a esiti avversi nel COVID-19. 19.
Dichiarazione di conflitti di interessi degli autori
ZV e AJF hanno contribuito equamente come primi autori, e RAS, FR e HM hanno contribuito equamente come ultimi autori. AJF riporta tassi di Alnylam, Amgen, AstraZeneca, Fresenius, Imedos Systems, Novartis, Pfizer, Roche, Vifor e Zoll, non correlati a questa corrispondenza. MRM riporta rapporti di consulenza con Abbott, Medtronic, Janssen, Mesoblast, Portola, Bayer, NupulseCV, FineHeart, Leviticus, Baim Institute for Clinical Research, Riovant e Triple Gene, non correlati a questa corrispondenza. FR è stato pagato per il tempo trascorso come membro di comitati per sperimentazioni cliniche, comitati consultivi, altre forme di consulenza, e per discorsi o presentazioni. Questi pagamenti sono stati effettuati direttamente all’Università di Zurigo e non sono stati ricevuti pagamenti personali in relazione a questi studi o ad altre attività. Tutti gli altri autori non dichiarano interessi concorrenti.
















