Herz-Kreislauf-Komplikationen stellen neben Atemwegserkrankungen zunehmend eine zentrale Bedrohung bei der Coronavirus-Krankheit 2019 (COVID-19) dar. Allerdings sind die Mechanismen, die der unverhältnismäßigen Wirkung einer Infektion mit dem schweren akuten respiratorischen Syndrom Coronavirus 2 (SARS-CoV-2) bei Patienten mit kardiovaskulären Komorbiditäten zugrunde liegen, noch nicht vollständig geklärt. 2
SARS-CoV-2 infiziert den Wirt über den Angiotensin-Converting-Enzym-2 -Rezeptor (ACE2), der in mehreren Organen exprimiert wird, darunter Lunge, Herz, Nieren und Darm. ACE2-Rezeptoren werden auch von Endothelzellen exprimiert.
Es ist derzeit nicht bekannt, ob die Gefäßerkrankungen bei COVID-19 auf die Beteiligung von Endothelzellen durch das Virus zurückzuführen sind. Interessanterweise kann SARS-CoV-2 in vitro hergestellte Organoide menschlicher Blutgefäße direkt infizieren.4
Hier demonstrieren wir die Beteiligung von Endothelzellen über Gefäßbetten verschiedener Organe bei einer Reihe von COVID-19-Patienten.
Patient 1 war ein 71-jähriger männlicher Nierentransplantatempfänger mit koronarer Herzkrankheit und Bluthochdruck. Der Zustand des Patienten verschlechterte sich nach der COVID-19-Diagnose und er benötigte eine mechanische Beatmung. Es kam zu einem Multisystemorganversagen und der Patient verstarb am 8. Tag.
Die Post-Mortem- Analyse der transplantierten Niere mittels Elektronenmikroskopie zeigte virale Einschlussstrukturen in den Endothelzellen (Abbildung A, B). In histologischen Analysen fanden wir eine Ansammlung von Endothel-assoziierten Entzündungszellen sowie apoptotischen Körpern im Herzen, im Dünndarm (Abbildung C) und in der Lunge (Abbildung D). In der Lunge wurde eine Ansammlung mononukleärer Zellen festgestellt, und die meisten kleinen Lungengefäße schienen verstopft zu sein.
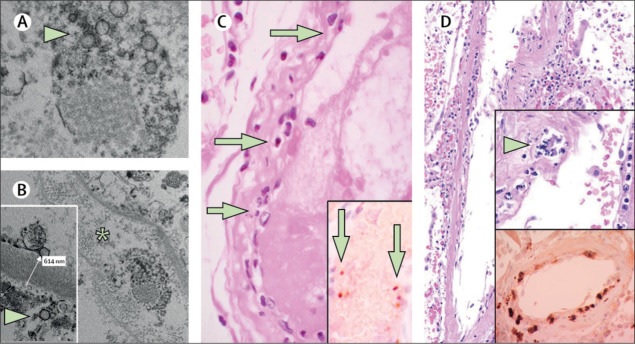
(A, B) Elektronenmikroskopie von Nierengewebe zeigt virale Einschlusskörperchen in einem peritubulären Raum und virale Partikel in den Endothelzellen glomerulärer Kapillarschleifen. Aggregate von Viruspartikeln (Pfeil) erscheinen mit einer dichten kreisförmigen Oberfläche und einem klaren Zentrum. Das Sternchen in Bild B markiert den peritubulären Raum, der mit der Kapillare übereinstimmt, die Viruspartikel enthält. Der Einschub in Bild B zeigt die glomeruläre Basalmembran mit Endothelzellen und einem Viruspartikel (Pfeil; ca. 150 nm Durchmesser). (C) Dünndarmresektionsprobe von Patient 3, gefärbt mit Hämatoxylin und Eosin. Die Pfeile weisen auf dominante mononukleäre Zellinfiltrate innerhalb der Intima entlang des Lumens vieler Gefäße hin. Der Einschub von Panel C zeigt die immunhistochemische Färbung von Caspase 3 in Dünndarmproben aus dem in Panel D beschriebenen Serienschnitt des Gewebes. Die Färbemuster stimmten mit der Apoptose von Endothelzellen und mononukleären Zellen überein, die in mit Hämatoxylin-Eosin gefärbten Schnitten beobachtet wurde. Dies weist darauf hin, dass in einem erheblichen Teil dieser Zellen Apoptose induziert wird. (D) Die mit Hämatoxylin und Eosin gefärbte postmortale Lungenprobe zeigte verdickte Lungensepten, darunter ein großes arterielles Gefäß mit mononukleärer und neutrophiler Infiltration (Pfeil im oberen Einschub). Der untere Einschub zeigt die immunhistochemische Färbung für Caspase 3 in derselben Lungenprobe; Diese Färbemuster stimmten mit der Apoptose von Endothelzellen und mononukleären Zellen überein, die in Hämatoxylin-Eosin-gefärbten Schnitten beobachtet wurde. COVID-19 = Coronavirus-Krankheit 2019.
Patientin 2 war eine Frau, 58 Jahre alt, mit Diabetes, Bluthochdruck und Fettleibigkeit. Sie entwickelte aufgrund von COVID-19 ein fortschreitendes Atemversagen und entwickelte anschließend ein Multiorganversagen und benötigte eine Nierenersatztherapie.
Am 16. Tag führte die mesenteriale Ischämie zur Entfernung des nekrotischen Dünndarms. Bei einer Rechtsherzinsuffizienz als Folge eines ST-Strecken-Hebungs-Myokardinfarkts kam es zu Kreislaufversagen, und der Herzstillstand führte zum Tod.
Die postmortale Histologie ergab eine lymphatische Endotheliitis in Lunge, Herz, Niere und Leber sowie eine Leberzellnekrose. Wir fanden histologische Hinweise auf einen Myokardinfarkt, aber keine Anzeichen einer lymphozytären Myokarditis. Die Histologie des Dünndarms zeigte eine Endotheliitis (Endothelialitis) der submukösen Gefäße.
Patient 3 war ein 69-jähriger Mann mit Bluthochdruck, der infolge von COVID-19 ein Atemversagen entwickelte und eine mechanische Beatmung benötigte. Die Echokardiographie zeigte eine verringerte linksventrikuläre Ejektionsfraktion. Bei mesenterialer Ischämie kam es zu einem Kreislaufkollaps und es wurde eine Dünndarmresektion durchgeführt, der Patient überlebte jedoch. Die Histologie der Dünndarmresektion ergab eine ausgeprägte Endotheliitis der submukösen Gefäße und apoptotischen Körper (Abbildung C).
Wir fanden Hinweise auf eine direkte Virusinfektion der Endothelzelle und eine diffuse Endothelentzündung. Obwohl das Virus den ACE2-Rezeptor nutzt, der von Pneumozyten in der Alveolarepithelauskleidung exprimiert wird, um den Wirt zu infizieren und dadurch Lungenschäden zu verursachen, wird der ACE2-Rezeptor auch häufig auf Endothelzellen exprimiert, die mehrere Organe durchqueren.3
Die Rekrutierung von Immunzellen, entweder durch direkte Virusinfektion des Endothels oder vermittelt durch das Immunsystem, kann zu einer weit verbreiteten endothelialen Dysfunktion im Zusammenhang mit Apoptose führen (Abbildung D). Das Gefäßendothel ist ein aktives parakrines, endokrines und autokrines Organ, das für die Regulierung des Gefäßtonus und die Aufrechterhaltung der Gefäßhomöostase von wesentlicher Bedeutung ist.
Die endotheliale Dysfunktion ist ein wesentlicher Faktor für die mikrovaskuläre Dysfunktion, da sie das Gefäßgleichgewicht in Richtung einer erhöhten Vasokonstriktion mit nachfolgender Organischämie, Entzündung mit damit verbundenem Gewebeödem und einem prokoagulierenden Zustand verschiebt .
Unsere Ergebnisse zeigen das Vorhandensein viraler Elemente in Endothelzellen und eine Ansammlung von Entzündungszellen, mit Hinweisen auf den Tod von Endothel- und Entzündungszellen. Diese Ergebnisse legen nahe, dass eine SARS-CoV-2-Infektion die Auslösung einer Endothelitis in verschiedenen Organen als direkte Folge der Virusbeteiligung (wie beim Vorhandensein von Viruskörpern beobachtet) und der Entzündungsreaktion des Wirts erleichtert .
Darüber hinaus könnte die Induktion von Apoptose und Pyroptose eine wichtige Rolle bei der Schädigung von Endothelzellen bei COVID-19-Patienten spielen. Die COVID-19-Endotheliitis könnte die systemische Mikrozirkulationsfunktion in verschiedenen Gefäßbetten und ihre klinischen Folgen bei Patienten mit COVID-19 erklären.
Diese Hypothese liefert eine Begründung für Therapien zur Stabilisierung des Endothels bei gleichzeitiger Bekämpfung der Virusreplikation, insbesondere mit entzündungshemmenden Anti-Zytokin-Medikamenten, ACE-Hemmern und Statinen 7, 8, 9, 10, 11.
Diese Strategie könnte besonders relevant für gefährdete Patienten mit bereits bestehender endothelialer Dysfunktion sein, die mit männlichem Geschlecht, Rauchen, Bluthochdruck, Diabetes, Fettleibigkeit und bestehenden Herz-Kreislauf-Erkrankungen verbunden ist, die alle mit unerwünschten Folgen bei COVID-19 verbunden sind. 19.
Erklärung zu Interessenkonflikten der Autoren
ZV und AJF trugen gleichermaßen als Erstautoren bei, und RAS, FR und HM trugen gleichermaßen als Letztautoren bei. AJF meldet Tarife von Alnylam, Amgen, AstraZeneca, Fresenius, Imedos Systems, Novartis, Pfizer, Roche, Vifor und Zoll, die nicht mit dieser Korrespondenz in Zusammenhang stehen. MRM berichtet über Beratungsbeziehungen mit Abbott, Medtronic, Janssen, Mesoblast, Portola, Bayer, NupulseCV, FineHeart, Leviticus, Baim Institute for Clinical Research, Riovant und Triple Gene, die nichts mit dieser Korrespondenz zu tun haben. FR wurde für die Zeit bezahlt, die er als Ausschussmitglied für klinische Studien, Beiräte, andere Formen der Beratung sowie für Vorträge und Präsentationen aufgewendet hat. Diese Zahlungen erfolgten direkt an die Universität Zürich und es gingen keine persönlichen Zahlungen im Zusammenhang mit diesen Gerichtsverfahren oder anderen Aktivitäten ein. Alle anderen Autoren erklären keine Interessenkonflikte.
















