Objectif de l’examen
La maladie à coronavirus 2019 (COVID-19) est à l’origine d’une morbidité et d’une mortalité importantes dans le monde. Ici, nous passons en revue la littérature à ce jour sur les conséquences à court et à long terme de l’infection cardiaque par le coronavirus-2 du syndrome respiratoire aigu sévère (SRAS-CoV-2).
Découvertes récentes
Les premiers rapports de cas décrivaient un spectre de manifestations cardiovasculaires du COVID-19, notamment la myocardite, la cardiomyopathie de stress, l’infarctus du myocarde et l’arythmie. Cependant, dans la plupart des cas, les lésions myocardiques liées au COVID-19 semblent être principalement dues à la gravité de la maladie grave plutôt qu’aux lésions myocardiques directes causées par des particules virales.
Bien que l’IRM cardiaque reste un outil puissant pour diagnostiquer la myocardite aiguë, elle doit être utilisée avec prudence compte tenu de la faible prévalence initiale de la myocardite.
Guider un athlète patient à retourner au sport (RTP) après une infection au COVID-19 est un processus difficile. Les données les plus récentes montrent que RTP a été une entreprise sécurisée utilisant un protocole de détection.
Des « longs COVID » ou séquelles post-aiguës d’une infection par le SRAS-CoV-2 ont également été décrites. Les symptômes signalés englobent un large éventail de troubles cardiopulmonaires et neurologiques, notamment la fatigue, les palpitations, les douleurs thoraciques, la dyspnée, la confusion mentale et la dysautonomie, y compris le syndrome de tachycardie posturale (POTS). La prise en charge du POTS/dysautonomie se concentre principalement sur l’éducation, l’exercice et le remplacement du sel et des liquides.
Résumé
Notre compréhension de l’impact du COVID-19 sur le système cardiovasculaire évolue constamment. Alors que nous entrons dans une nouvelle ère de survie, des recherches supplémentaires sont nécessaires pour répertorier le fardeau des symptômes cardio-pulmonaires persistants. Des recherches sont également nécessaires pour comprendre comment une prise en charge aiguë peut modifier la probabilité et la prévalence de ce syndrome chronique.
En 2020, la maladie à coronavirus 2019 (COVID-19) était la troisième cause de décès avec environ 345 323 décès aux États-Unis. Peut-être plus que toute autre maladie transmissible, la COVID-19 a captivé la communauté de la cardiologie en raison de ses liens apparents avec les maladies cardiovasculaires. maladies (MCV).
La nouveauté du virus a conduit à s’appuyer très tôt sur de petits rapports de cas et des explications théoriques pour expliquer et prédire l’impact sur les maladies cardiovasculaires. Aujourd’hui, plus d’un an depuis le début de la pandémie, des études plus approfondies ont émergé qui affinent notre compréhension de l’interaction entre le COVID-19 et le cœur.
Au début de la pandémie, les patients présentant des comorbidités cardiovasculaires étaient plus vulnérables aux infections graves. La spécificité du coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2) pour la protéine de l’enzyme de conversion de l’angiotensine-2 (ACE-2) a alimenté d’autres inquiétudes concernant les lésions du système cardiovasculaire et suscité des craintes quant à l’utilisation concomitante de médicaments, y compris l’angiotensine. -les inhibiteurs de l’enzyme de conversion et les bloqueurs des récepteurs de l’angiotensine.
Les premiers rapports de cas décrivaient un spectre de manifestations cardiovasculaires de l’infection au COVID-19, notamment la myocardite, la cardiomyopathie de stress, l’infarctus du myocarde (IM) et l’arythmie. Pour lutter contre une nouvelle maladie, la communauté cardiologique a déployé sa technologie la plus avancée, notamment la résonance magnétique cardiaque (CMR), qui a caractérisé les conséquences aiguës et chroniques de l’infection par le SRAS-CoV-2, mais les résultats ont souvent laissé les médecins avec plus de questions. que les réponses.
Aujourd’hui, plus d’un an après les premiers cas signalés en 2020, la communauté mondiale se trouve à un moment critique dans la chronologie de la pandémie. Alors que le nombre de survivants est supérieur à celui des personnes infectées et que les vaccins sont en cours de distribution, une plus grande attention pourrait être accordée aux effets cardiovasculaires à long terme du COVID-19.
Cependant, alors que les poussées se poursuivent dans le monde entier en raison de nouveaux variants et d’un retard dans la distribution des vaccins, la communauté médicale doit rester informée des dernières avancées en matière de gestion de l’infection aiguë au COVID-19, fondée sur des données probantes.
Partie I : Infection aiguë
Mécanismes des lésions cardiaques dans le contexte du COVID-19
La troponine cardiaque est un test hautement spécifique pour les lésions myocardiques, qui peut être mesurée par des tests conventionnels ou très sensibles. En particulier, une troponine élevée (définie comme étant supérieure au 99e centile de la limite supérieure de référence) n’équivaut pas nécessairement à un IM. Selon la 4e définition universelle, les critères d’un IM nécessitent un schéma d’augmentation/diminution de la troponine avec au moins une valeur supérieure au 99e percentile ainsi que d’autres symptômes ou signes d’ischémie.
| Un infarctus du myocarde (IM) de type 1 survient à la suite d’un événement aigu de rupture/érosion de plaque, qui a également été observé dans le contexte d’autres infections virales, tandis qu’un IM de type 2 est dû à une « ischémie de demande » dans le contexte d’une demande/d’oxygène. inadéquation de l’approvisionnement résultant de facteurs de stress tels que l’hypoxie, l’hypoperfusion et la tachycardie, qui peuvent survenir dans le cadre de la COVID-19, ainsi que d’autres maladies graves. Les deux types d’IM ont été signalés dans le cadre de la COVID-19. |
Cependant, paradoxalement, il y a eu une réduction d’environ 20 % des taux d’infarctus du myocarde avec élévation du segment ST (STEMI) pendant la pandémie de COVID-19. Des mécanismes alternatifs ont été avancés pour expliquer cette réduction du STEMI, mais la principale préoccupation était que les patients évitaient les soins hospitaliers par crainte de contracter le virus.
Au-delà de l’infarctus aigu du myocarde, l’élévation de la troponine peut accompagner un certain nombre d’autres présentations cardiovasculaires du COVID-19, notamment la myocardite virale, les lésions cardiaques indirectes dues à une tempête de cytokines, la cardiomyopathie de stress, l’insuffisance cardiaque (IC), les troubles pulmonaires et les arythmies d’accident vasculaire cérébral, ou refléter une maladie cardiovasculaire ou cardiaque. anomalies structurelles.
La prévalence des lésions cardiaques, mesurée par une troponine cardiaque élevée, de l’ordre de 20 à 40 % parmi les premiers patients signalés atteints d’une forme grave de COVID-19 (hospitalisés), a attiré l’attention de la cardiologie et de la communauté médicale au sens large. À mesure que la virologie du SRAS-CoV-2 devenait claire, son interaction avec la protéine ACE2 présente dans les cardiomyocytes a confirmé la plausibilité physiologique d’une lésion virale cardiaque directe .
Un précédent a été établi avec un coronavirus apparenté, le SRAS-CoV-1, qui a provoqué la première épidémie de SRAS en Asie, au cours de laquelle l’ARN viral a été isolé dans le tissu cardiaque. De plus, il a été démontré que les personnes atteintes de maladies cardiovasculaires, telles que la maladie coronarienne (CHD) et l’IC, et celles présentant des facteurs de risque de maladies cardiovasculaires, tels que l’hypertension, le diabète et l’obésité, étaient plus susceptibles aux infections graves, ce qui soulève des inquiétudes quant au fait que le cœur pourrait être une cause directe. cible virale et devenir plus vulnérable s’il est compromis.
Concernant l’étiologie des lésions myocardiques liées au COVID-19, nos connaissances ont évolué depuis le début de l’épidémie. Des études histopathologiques plus vastes ont remis en question les premiers cadres de lésions cardiaques, démontrant que la prévalence de la myocardite et la toxicité virale directe sur les myocytes sont extrêmement rares .
Dans l’une des plus grandes séries d’autopsies cardiaques à ce jour, Lindner et al. Ils ont montré que, bien que l’ARN viral ait été isolé dans le tissu cardiaque, l’hybridation in situ localisait le site de l’infection non pas dans les cardiomyocytes, mais dans l’interstitium et les macrophages infiltrants. De plus, il n’y a eu aucun cas confirmé de myocardite selon les critères de Dallas. D’autres études pathologiques n’ont pas non plus réussi à documenter l’infection directe des cardiomyocytes.
En particulier, comme les caractéristiques du nouveau coronavirus ont été rapidement répertoriées au début de la pandémie, peu de choses ont été faites pour les comparer avec des groupes témoins appropriés. Des recherches récentes ont placé la COVID-19 dans le contexte plus large du paysage des soins intensifs.
Metkus et ses collègues ont comparé l’élévation de la troponine dans le syndrome de détresse respiratoire aiguë (SDRA) lié au COVID-19 par rapport au SDRA non lié au COVID-19 parmi près de 250 patients intubés dans un grand système hospitalier et ont montré que les lésions myocardiques étaient en réalité moins fréquentes dans le cas du COVID-19 que dans les cas non- COVID-19. -Patients atteints du SDRA COVID-19 après avoir pris en compte le degré de maladie grave et de dysfonctionnement des organes. Les patients atteints de COVID-19 présentaient une oxygénation et une hémodynamique pires, renforçant les lésions cardiaques indirectes secondaires à une maladie grave comme mécanisme le plus probable en jeu.
Ces résultats sont renforcés par les taux élevés de lésions myocardiques observés dans les infections systémiques autres que le COVID-19, y compris le sepsis, documentés dans la littérature sur les soins intensifs.]
Bien que d’autres manifestations cardiaques telles que la myocardite, la cardiomyopathie de stress et l’infarctus du myocarde aient été décrites dans le cadre de la COVID-19 et ne doivent pas être écartées, le fait de placer la COVID-19 dans le contexte d’autres maladies graves a recalibré notre compréhension de la blessure. myocardique pour reconnaître des mécanismes plus répandus tels que l’hypoxémie et le compromis hémodynamique.
Bien que les lésions myocardiques liées à la COVID-19 ne soient pas propres au virus, le degré de maladie grave qu’elles peuvent provoquer témoigne d’attributs pathogènes uniques.
Le mécanisme responsable est probablement lié à sa capacité à stimuler une réponse inflammatoire robuste . Dans les études sur les lésions myocardiques liées au COVID-19, les prédicteurs de l’élévation de la troponine ont systématiquement démontré des associations avec des marqueurs inflammatoires, notamment la protéine C-réactive (CRP), les D-dimères, la ferritine et le fibrinogène. Des études pathologiques ont étayé cette relation en démontrant une expression accrue des cytokines avec des charges virales plus élevées.
Alors que la phase hyperinflammatoire est à l’origine d’une grande partie du compromis respiratoire et circulatoire à l’origine des lésions myocardiques indirectes en cas d’infection grave, l’inflammation était auparavant connue pour médier directement les maladies cardiovasculaires, comme on le voit dans l’athérosclérose et d’autres états hyperinflammatoires, notamment la septicémie et la lymphohistiocytose hémophagocytaire (HLH).
Les cardiomyocytes expriment des récepteurs de cytokines, notamment le facteur de nécrose tumorale et l’interleukine-6, dont les effets peuvent réduire l’inotropie secondaire à des altérations de la signalisation des catécholamines et provoquer des dommages cytotoxiques. De plus, les cytokines modifient l’endothélium vasculaire pour favoriser la migration inflammatoire et peuvent provoquer une endothélite, des microthrombus et des lésions microvasculaires décrites dans le COVID-19.
L’échocardiographie a affiné davantage notre compréhension des lésions myocardiques liées au COVID-19, en détaillant certains modèles fonctionnels de blessures . Szekely et coll. ont découvert que le dysfonctionnement du ventricule droit (VD) était l’anomalie échocardiographique la plus courante dans une série de 100 patients hospitalisés atteints de COVID-19, parmi près de 40 %, la détérioration du VD étant la plus associée aux décompensations cliniques. Le dysfonctionnement du VD était également l’anomalie la plus courante observée dans une cohorte internationale multicentrique de plus de 300 patients hospitalisés atteints de COVID-19, soit environ 26 %.
Cependant, dans les deux études, un spectre complet de dysfonctionnements a été observé, notamment un dysfonctionnement systolique du ventricule gauche (VG) global et régional, un dysfonctionnement diastolique et des épanchements péricardiques. La prévalence du dysfonctionnement du RV indique que le COVID-19 est un agent pathogène principalement respiratoire avec une propension à la thrombose veineuse profonde et à l’embolie pulmonaire, qui peuvent toutes compromettre la résistance vasculaire pulmonaire et augmenter les conditions de charge du RV.
Élévation de la troponine : implications pronostiques
Laissant de côté le mécanisme de blessure, l’élévation détectable de la troponine a une valeur pronostique dans l’infection aiguë au COVID-19. Shi et ses collègues ont été parmi les premiers à signaler une mortalité accrue chez les personnes présentant un taux de troponine élevé dans une cohorte monocentrique de Wuhan, constatant un risque de décès de trois à quatre fois.
Par la suite, Lombardi et al. Ils ont validé ces résultats dans une cohorte multicentrique en Italie comprenant plus de 600 patients, mais avec un risque relatif plus atténué de 1,7. Dans l’une des cohortes les plus diversifiées étudiées avec plus de 2 000 patients admis dans un système hospitalier de la ville de New York, Smilowitz et al. Ils ont montré que le risque de décès était deux fois plus élevé chez les patients présentant une élévation de la troponine.
Il est important de noter que le degré d’élévation de la troponine était associé à une maladie grave plus grave (définie comme une admission en soins intensifs, un besoin de ventilation mécanique ou un décès).
Alors que ces études fondamentales ont défini l’élévation de la troponine comme supérieure au 99e percentile de la limite supérieure de la normale, Qin et ses collègues ont illustré que l’élévation de la troponine dans l’infection au COVID-19 était associée à la mortalité, même à de faibles seuils. 19 à 50 % inférieurs à ceux traditionnellement utilisés en milieu.
De plus, le risque de mortalité et d’effets indésirables semble être continu avec le degré d’élévation de la troponine ; Une troponine élevée continue d’amplifier le risque, fournissant aux cliniciens une évaluation quantitative et pas seulement qualitative du risque pour les patients. En tant que tel, la mesure de la troponine pour les patients hospitalisés atteints de COVID-19 a été intégrée aux algorithmes de pratique clinique et de gestion de routine.
Dans le cas des hôpitaux, il sert à prévoir la trajectoire et à identifier les patients qui peuvent nécessiter des ressources plus intensives, notamment en période de pénurie. Plusieurs directives de la société, dont l’Organisation mondiale de la santé et les directives cliniques chinoises pour le COVID-19, recommandent de mesurer la troponine pour tous les patients admis, tandis que d’autres, notamment l’American College of Cardiology (ACC), recommandent des tests lorsque cela est cliniquement indiqué.
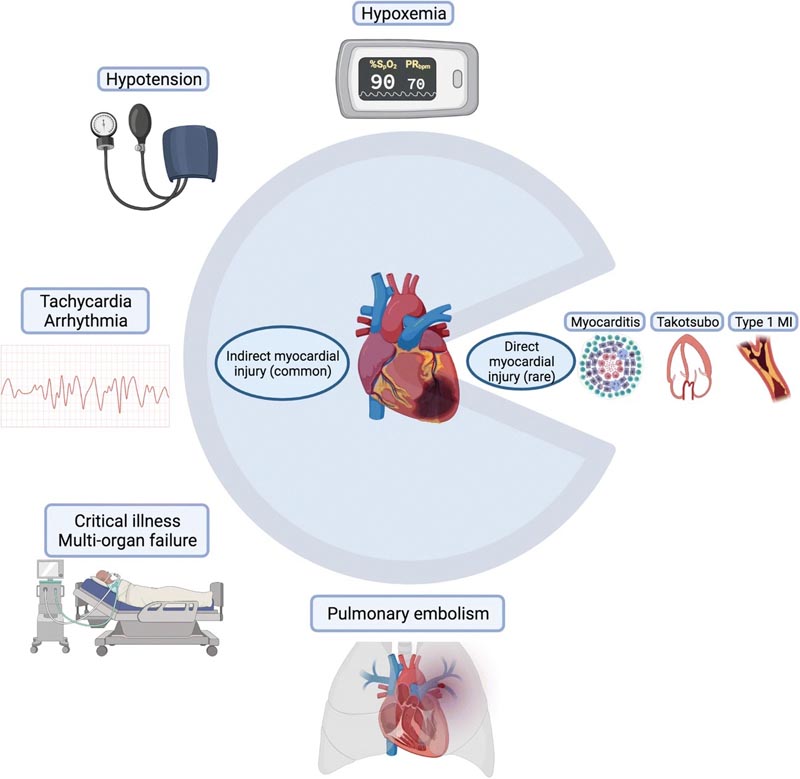
Diagramme circulaire symbolique illustrant les causes courantes de lésions myocardiques indirectes et les causes plus rares de lésions myocardiques directes lors d’une infection au COVID-19
Rôle de la résonance magnétique cardiaque (CMR)
La plausibilité physiopathologique du COVID-19 provoquant une infection directe du myocarde et les premiers rapports de cas évoquant une myocardite ont conduit à un intérêt accru pour l’utilisation du CMR, désormais la modalité de diagnostic non invasive préférée pour la myocardite aiguë. Les premiers rapports de cas de myocardite dans le cadre d’une infection aiguë au COVID-19 ont fait état d’une prévalence d’environ 7 % ; cependant, ces études étaient erronées en raison de critères de diagnostic incohérents et de tailles d’échantillon limitées.
Comme indiqué ci-dessus dans le contexte des études histopathologiques, la prévalence de la myocardite dans le COVID-19 est désormais considérée comme extrêmement rare , et des études de cohorte rétrospectives multicentriques plus vastes ont montré qu’elle était de 1 % ou moins.
Reconnaître la faible probabilité pré-test de myocardite à COVID-19 et considérer les causes les plus probables de lésions myocardiques éclairent l’utilisation appropriée du CMR. En particulier avec le CMR, la durée d’analyse plus longue et la logistique nécessaire pour permettre les examens chez les patients intubés (y compris les patients passant vers et depuis des ventilateurs sécurisés par scanner) augmentent le risque d’exposition pour les travailleurs de la santé.
Partie II : Résolution de l’infection au COVID-19
et retour au jeu pour les athlètes
La question de savoir quand un athlète de compétition peut retourner au jeu (RTP) après une infection au COVID-19 pose un défi urgent et important pour le domaine de la cardiologie. L’urgence est motivée par le fait que les organisations sportives, professionnelles ou récréatives, ont été parmi les premières à revenir à toute vitesse pendant la pandémie. Cette ruée collective vers le retour a commencé avec peu de données sur la manière de le faire en toute sécurité après une infection.
L’importance était évidente, car la myocardite est une séquelle possible de l’infection au COVID-19 et une cause de décès chez les jeunes athlètes. Faire de l’exercice avec une myocardite active peut entraîner une inflammation accrue et un environnement proarythmogène . De plus, le cœur d’un athlète peut présenter des anomalies de taille, de fonction et de réponse à l’exercice qui rendent difficile sa distinction avec un cœur enflammé ou blessé.
Un exercice intense peut provoquer des élévations transitoires des troponines et des résultats d’imagerie suggérant une fatigue cardiaque et une inflammation du myocarde. Alors que des milliers d’athlètes étaient impatients de reprendre l’action, la manière de le faire en toute sécurité est devenue un sujet central dans le domaine de la cardiologie tout au long de la pandémie.
En mai 2020, la section de cardiologie du sport et de l’exercice de l’ACC a publié sa première série de recommandations RTP. Pour les athlètes ayant présenté une infection symptomatique, ils ont recommandé une période de repos de 2 semaines après la résolution des symptômes, une évaluation cardiaque (électrocardiogramme, échocardiogramme ou troponine à haute sensibilité) et une imagerie cardiaque supplémentaire en cas d’anomalies.
Si une myocardite était détectée, les médecins étaient orientés vers les lignes directrices existantes de l’American Heart Association (AHA)/ACC sur la myocardite, qui recommandent de s’abstenir de tout sport pendant 3 à 6 mois . Six mois plus tard, la Section a mis à jour et élargi ces lignes directrices pour inclure des recommandations spécifiques basées sur l’âge et des recommandations détaillées sur le dépistage de la troponine et du CMR. Une déclaration de consensus d’experts a suivi, recommandant de ne pas utiliser le dépistage basé sur le CMR pour tous les athlètes ayant déjà été infectés par le COVID-19.
Heureusement, les données d’enregistrement les plus récentes montrent que le RTP national a été une entreprise sûre. Une étude portant sur 789 athlètes professionnels qui ont subi un protocole de test cardiaque RTP après une infection au COVID-19 a trouvé des preuves d’imagerie d’une maladie cardiaque inflammatoire chez 5 athlètes (0,6 %). Le protocole de dépistage cardiaque comprenait la troponine, l’ECG et l’échocardiographie transthoracique ; L’échographie CMR ou échocardiographie de stress n’a été réalisée que chez les athlètes présentant un dépistage cardiaque initial anormal .
Aucun événement cardiaque indésirable n’est survenu chez les athlètes qui ont subi des tests cardiaques et sont retournés au jeu.
Guider un patient dans son retour à l’athlétisme après une infection au COVID-19 est un processus difficile. Les données sur la COVID-19 évoluent rapidement, la cardiologie sportive est un domaine relativement naissant et le cœur sportif est un substrat unique. Cela se combine pour produire plus d’incertitude que de réponses claires à l’approche du retour au jeu. Cependant, à mesure que le temps passe et que davantage de données sont apparues, ce retour, lorsqu’il est guidé par les recommandations de dépistage actuelles, peut se faire en toute sécurité.
longue COVID
Alors que les travailleurs de la santé et les chercheurs continuent d’apprendre, de classer et de traiter les risques cardiovasculaires aigus du COVID-19, de nombreux prestataires ambulatoires sont inondés de patients présentant des symptômes persistants après une infection aiguë, connue dans les médias populaires sous le nom de « « Long COVID ». »
Avec une meilleure reconnaissance de ce syndrome, les chercheurs ont établi les définitions suivantes :
- Syndrome COVID post-aigu (PACS) pour les symptômes persistants après 3 semaines.
- Syndrome COVID chronique : après 12 semaines.
Les National Institutes of Health ont également qualifié le « long COVID » de séquelles post-aiguës de l’infection par le SRAS-CoV-2 (PASC). Les symptômes signalés englobent un large éventail de troubles cardiopulmonaires et neurologiques, notamment la fatigue, les palpitations, les douleurs thoraciques, la dyspnée, la confusion mentale et la dysautonomie.
Alors que les premières études estimaient la prévalence du COVID long entre 30 et 80 %, elles étaient limitées par le fait qu’elles se concentraient principalement sur les patients hospitalisés. Au sein d’une cohorte non hospitalisée de 272 personnes aux États-Unis, 35 % ont déclaré ne pas être au départ 14 à 21 jours après le diagnostic de COVID-19.
De nouvelles études utilisent la technologie mobile pour permettre aux intervenants de surveiller et de signaler directement leurs symptômes pour le suivi des symptômes aigus et à long terme. Alors que les personnes âgées présentant de multiples comorbidités courent un risque plus élevé de COVID long, environ 20 % des personnes plus jeunes, âgées de 18 à 34 ans et sans comorbidités, ont également continué à signaler des symptômes persistants entre 14 et 21 jours.
Concernant les symptômes cardiovasculaires spécifiques, environ 20 % des individus ont signalé des douleurs thoraciques et 14 % des palpitations à 60 jours. On pense que l’inflammation et l’augmentation de la demande métabolique et myocardique contribuent à la persistance des symptômes cardiovasculaires, comme cela a été observé dans d’autres infections graves à coronavirus telles que le SRAS.
Un nombre croissant de patients et d’études de cas notent également une relation entre le COVID-19 et le syndrome de tachycardie orthostatique posturale (POTS). Le POTS se caractérise par des changements de fréquence cardiaque avec des changements de position, souvent accompagnés de palpitations et d’une diminution de la tolérance à l’exercice. Le POTS a déjà été associé à des maladies post-virales, mais le mécanisme exact est inconnu.
Une hypothèse reliant le POTS au COVID-19 repose sur son interaction connue avec la protéine ACE2 exprimée dans les neurones. Les enquêteurs émettent l’hypothèse que cela pourrait perturber la régulation normale de la pression artérielle médiée par l’ACE2, conduisant à une hypotension et une dysautonomie. La prise en charge du POTS et de la dysautonomie se concentre principalement sur l’éducation, l’exercice et le remplacement du sel et des liquides. Des agents tels que la midodrine peuvent améliorer le tonus vasculaire, tandis que les bêtabloquants et l’ivabradine peuvent aider à contrôler les palpitations.
Avec 20 à 30 % des patients ambulatoires et jusqu’à 80 % des patients hospitalisés présentant des symptômes persistants, les prestataires et les chercheurs ont désormais la responsabilité de reconnaître et de gérer le fardeau persistant de l’infection au COVID-19. Beaucoup se rétablissent lentement par eux-mêmes grâce à des conseils anticipatifs et à des exercices légers.
Cependant, la British Thoracic Society a établi des lignes directrices pour le suivi de tous les patients , quelle que soit leur gravité, à 12 semaines avec une radiographie pulmonaire et une évaluation clinique pour évaluer la nécessité de tests supplémentaires.
Il est recommandé aux personnes atteintes d’une forme grave de COVID-19 d’effectuer un suivi plus tôt, entre 4 et 6 semaines, afin d’évaluer la nécessité de tests supplémentaires et d’une réadaptation multidisciplinaire. Des électrocardiogrammes et des échocardiogrammes en série peuvent être utilisés pour surveiller les personnes présentant des symptômes cardiaques persistants, bien que l’imagerie avancée doive être analysée au cas par cas.
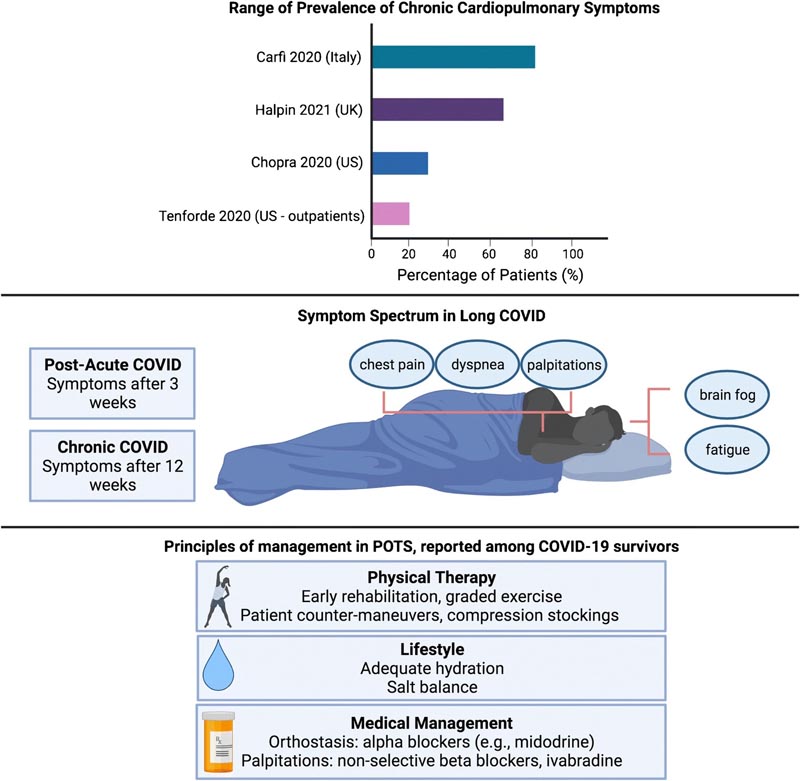
Examen de la prévalence de la COVID longue, des définitions et des manifestations symptomatiques, ainsi que des principes de traitement actuels pour un éventuel chevauchement du syndrome de tachycardie orthostatique orthostatique COVID/posturale
Conclusion Cela fait un certain temps que la communauté médicale mondiale n’a pas été confrontée à une nouvelle maladie aux proportions pandémiques. Percer les mystères du COVID-19 a été un exercice de science et d’expérimentation assidue. Les dernières études observationnelles, pathologiques, d’imagerie et cliniques ont clarifié les impacts à court et à long terme du COVID-19 sur le système cardiovasculaire et ont mis à jour nos connaissances de plusieurs manières. Les lésions myocardiques dans le COVID-19 semblent être principalement médiées par la gravité de la maladie grave plutôt que par les lésions myocardiques directes causées par des particules virales. Bien que les lésions myocardiques ne soient pas uniques au COVID-19 et soient observées ailleurs dans la littérature sur les soins intensifs concernant le sepsis et le SDRA, la réponse hyperinflammatoire précipitée par le COVID-19 est une caractéristique unique et peut arbitrer les évolutions cliniques les plus graves. observé en comparaison avec d’autres virus. Au contraire, la COVID-19 a renforcé l’interaction critique entre l’inflammation et les maladies cardiovasculaires et devrait orienter les travaux futurs dans ce domaine. Alors que les lésions myocardiques sous forme d’élévation de la troponine sont répandues et pronostiques dans les infections aiguës au COVID-19, des études récentes suggèrent que l’élévation de la troponine est un marqueur de la gravité de la maladie et du substrat sous-jacent, plutôt qu’un médiateur. indépendant des résultats. Bien que le CMR reste un outil puissant pour diagnostiquer la myocardite aiguë, il doit être utilisé avec prudence à la lumière de la faible prévalence de base établie dans les études menées à ce jour, ainsi que du risque d’exposition du personnel de santé. Des études sont nécessaires pour comprendre la pertinence clinique des signaux inflammatoires persistants observés chez les survivants et comment ceux-ci peuvent être comparés ou contrastés avec ceux qui se rétablissent d’autres virus courants ou de maladies graves. Le CMR pourrait jouer un rôle plus ciblé en fournissant des recommandations aux populations à risque telles que les athlètes ; cependant, elle devrait rarement constituer la modalité de première intention et les résultats de l’imagerie à eux seuls ne devraient pas servir de base au diagnostic de myocardite aiguë. Enfin, alors que nous entrons dans une nouvelle ère de survie, des recherches supplémentaires sont nécessaires pour répertorier le fardeau des symptômes cardio-pulmonaires persistants qui ont des implications significatives sur le bien-être des patients et sur les économies mondiales en ce qui concerne la capacité de retourner au travail. Des recherches sont également nécessaires pour confirmer si les thérapies existantes contre la dysautonomie, y compris le POTS, sont efficaces dans la population souffrant d’une longue COVID, et comment la prise en charge aiguë peut modifier la probabilité et la prévalence de ce syndrome chronique. Même si des questions demeurent et continueront de se poser concernant la COVID-19 et les maladies cardiovasculaires, la pandémie a montré que la communauté scientifique est particulièrement engagée et capable de fournir ces réponses cruciales. |