Zweck der Überprüfung
Die Coronavirus-Krankheit 2019 (COVID-19) ist weltweit die Ursache für erhebliche Morbidität und Mortalität. Hier überprüfen wir die bisherige Literatur zu den kurz- und langfristigen Folgen einer schweren Herzinfektion mit dem akuten respiratorischen Syndrom Coronavirus-2 (SARS-CoV-2).
Aktuelle Erkenntnisse
Frühe Fallberichte beschrieben ein Spektrum kardiovaskulärer Manifestationen von COVID-19, darunter Myokarditis, Stresskardiomyopathie, Myokardinfarkt und Arrhythmie. In den meisten Fällen scheint die Myokardschädigung bei COVID-19 jedoch hauptsächlich durch die Schwere der kritischen Erkrankung und nicht durch eine direkte Myokardschädigung durch Viruspartikel verursacht zu werden.
Obwohl die Herz-MRT nach wie vor ein wirksames Instrument zur Diagnose einer akuten Myokarditis ist, sollte sie angesichts der niedrigen Ausgangsprävalenz von Myokarditis mit Vorsicht eingesetzt werden.
Einen geduldigen Sportler nach einer COVID-19-Infektion bei der Rückkehr zum Sport (RTP) zu unterstützen, ist ein herausfordernder Prozess. Die neuesten Daten zeigen, dass RTP ein sicheres Unterfangen unter Verwendung eines Erkennungsprotokolls war.
Auch „Long COVID“ oder postakute Folgen einer SARS-CoV-2-Infektion wurden beschrieben. Die gemeldeten Symptome umfassen ein breites Spektrum kardiopulmonaler und neurologischer Beschwerden, darunter Müdigkeit, Herzklopfen, Brustschmerzen, Atemnot, geistige Verwirrung und Dysautonomie, einschließlich des posturalen Tachykardie-Syndroms (POTS). Die Behandlung von POTS/Dysautonomie konzentriert sich hauptsächlich auf Bildung, Bewegung sowie Salz- und Flüssigkeitsersatz.
Zusammenfassung
Unser Verständnis der Auswirkungen von COVID-19 auf das Herz-Kreislauf-System entwickelt sich ständig weiter. Da wir in eine neue Ära des Überlebens eintreten, ist zusätzliche Forschung erforderlich, um die Belastung durch anhaltende kardiopulmonale Symptome zu katalogisieren. Es sind auch Forschungsarbeiten erforderlich, um zu verstehen, wie eine akute Behandlung die Wahrscheinlichkeit und Prävalenz dieses chronischen Syndroms verändern kann.
Einführung
Im Jahr 2020 war die Coronavirus-Krankheit 2019 (COVID-19) mit geschätzten 345.323 Todesfällen in den USA die dritthäufigste Todesursache. Vielleicht mehr als jede andere übertragbare Krankheit hat COVID-19 die Gemeinschaft der Kardiologen aufgrund seiner offensichtlichen Verbindungen zum Herz-Kreislauf-System in seinen Bann gezogen Krankheiten (CVD).
Die Neuheit des Virus führte dazu, dass man sich schon früh auf kleine Fallberichte und theoretische Erklärungen verließ, um die Auswirkungen auf Herz-Kreislauf-Erkrankungen zu erklären und vorherzusagen. Jetzt, mehr als ein Jahr nach Beginn der Pandemie, sind ausgereiftere Studien aufgetaucht, die unser Verständnis der Wechselwirkung zwischen COVID-19 und dem Herzen verfeinern.
Zu Beginn der Pandemie waren Patienten mit kardiovaskulären Begleiterkrankungen anfälliger für schwere Infektionen. Die Spezifität des schweren akuten respiratorischen Syndroms Coronavirus 2 (SARS-CoV-2) für das Angiotensin-Converting-Enzym-2 (ACE-2)-Protein schürte weitere Bedenken hinsichtlich einer Schädigung des Herz-Kreislauf-Systems und ließ Befürchtungen hinsichtlich der gleichzeitigen Einnahme von Medikamenten, einschließlich Angiotensin, aufkommen -Converting-Enzym-Hemmer und Angiotensin-Rezeptor-Blocker.
Frühe Fallberichte beschrieben ein Spektrum kardiovaskulärer Manifestationen einer COVID-19-Infektion, darunter Myokarditis, Stresskardiomyopathie, Myokardinfarkt (MI) und Arrhythmie. Um eine neue Krankheit zu bekämpfen, setzte die kardiologische Gemeinschaft ihre fortschrittlichste Technologie ein, darunter die kardiale Magnetresonanz (CMR), die die akuten und chronischen Folgen einer SARS-CoV-2-Infektion charakterisiert hat, aber die Ergebnisse lassen Ärzte oft mit weiteren Fragen zurück als Antworten.
Jetzt, mehr als ein Jahr seit den ersten gemeldeten Fällen im Jahr 2020, befindet sich die Weltgemeinschaft an einem kritischen Punkt im Verlauf der Pandemie. Da die Überlebenden zahlreicher sind als die Infizierten und Impfstoffe verteilt werden, könnte den langfristigen kardiovaskulären Auswirkungen von COVID-19 mehr Aufmerksamkeit geschenkt werden.
Da der Anstieg aufgrund neuer Varianten und einer Verzögerung bei der Impfstoffverteilung weltweit jedoch anhält, muss die medizinische Gemeinschaft über die neueste evidenzbasierte Behandlung akuter COVID-19-Infektionen informiert bleiben.
Teil I: Akute Infektionsmechanismen
einer Herzschädigung bei COVID-19
Herztroponin ist ein hochspezifischer Test für Myokardschäden, der mit herkömmlichen oder hochempfindlichen Tests gemessen werden kann. Insbesondere ist ein erhöhter Troponinwert (definiert als über dem 99. Perzentil des oberen Referenzgrenzwerts) nicht unbedingt gleichbedeutend mit einem Myokardinfarkt. Gemäß der 4. universellen Definition erfordern die Kriterien für einen MI ein Troponin-Anstiegs-/Abfallmuster mit mindestens einem Wert über dem 99. Perzentil sowie andere Symptome oder Anzeichen einer Ischämie.
| Ein Myokardinfarkt (MI) vom Typ 1 entsteht durch ein akutes Plaque-Ruptur-/Erosionsereignis, das auch im Zusammenhang mit anderen Virusinfektionen beobachtet wurde, während ein Myokardinfarkt (MI) vom Typ 2 durch eine „Bedarfsischämie“ im Zusammenhang mit einem Sauerstoffbedarf entsteht. Versorgungsungleichgewichte aufgrund von Stressfaktoren wie Hypoxie, Minderdurchblutung und Tachykardie, die bei COVID-19 auftreten können, sowie anderen kritischen Erkrankungen. Bei COVID-19 wurde über beide Arten von Myokardinfarkten berichtet. |
Paradoxerweise kam es jedoch während der COVID-19-Pandemie zu einem Rückgang der ST-Hebungs-Myokardinfarktraten (STEMI) um etwa 20 % . Für diesen Rückgang des STEMI wurden alternative Mechanismen postuliert, die Hauptsorge bestand jedoch darin, dass Patienten aus Angst vor einer Ansteckung mit dem Virus die Krankenhausbehandlung meiden.
Über den akuten Myokardinfarkt hinaus kann ein Troponinanstieg mit einer Reihe anderer kardiovaskulärer Symptome von COVID-19 einhergehen, darunter virale Myokarditis, indirekte Herzschädigung durch Zytokinsturm, Stresskardiomyopathie, Herzinsuffizienz (HF), Schlaganfall, Lungenerkrankungen und Arrhythmien, oder auf kardiovaskuläre oder kardiale Erkrankungen zurückzuführen sein strukturelle Anomalien.
Die Prävalenz von Herzschäden, gemessen am erhöhten kardialen Troponin, in der Größenordnung von 20–40 % bei den ersten gemeldeten (hospitalisierten) Patienten mit schwerem COVID-19 erregte die Aufmerksamkeit der Kardiologie und der breiteren medizinischen Gemeinschaft. Als die Virologie von SARS-CoV-2 klar wurde, stützte seine Wechselwirkung mit dem in Kardiomyozyten gefundenen ACE2-Protein die physiologische Plausibilität einer direkten Herzvirusschädigung .
Ein Präzedenzfall wurde mit einem verwandten Coronavirus, SARS-CoV-1, geschaffen, das den ersten SARS-Ausbruch in Asien verursachte, bei dem virale RNA im Herzgewebe isoliert wurde. Darüber hinaus wurde gezeigt, dass Personen mit Herz-Kreislauf-Erkrankungen wie koronarer Herzkrankheit (KHK) und Herzinsuffizienz sowie Personen mit Herz-Kreislauf-Risikofaktoren wie Bluthochdruck, Diabetes und Fettleibigkeit anfälliger für schwere Infektionen sind, was Bedenken aufkommen lässt, dass das Herz eine direkte Infektion sein könnte virales Ziel und werden bei Kompromittierung anfälliger.
Bezüglich der Ätiologie der Myokardschädigung bei COVID-19 hat sich unser Wissen seit Beginn des Ausbruchs weiterentwickelt. Größere histopathologische Studien haben frühe Hintergründe einer Herzschädigung in Frage gestellt und gezeigt, dass die Prävalenz von Myokarditis und eine direkte virale Toxizität für Myozyten äußerst selten sind .
In einer der bisher größten Herz-Autopsie-Serien haben Lindner et al. Sie zeigten, dass, obwohl virale RNA im Herzgewebe isoliert wurde, die In-situ -Hybridisierung die Infektionsstelle nicht auf Kardiomyozyten, sondern auf das Interstitium und infiltrierende Makrophagen lokalisierte. Darüber hinaus gab es nach den Dallas-Kriterien keine bestätigten Fälle von Myokarditis. Auch andere pathologische Studien konnten keine direkte Infektion von Kardiomyozyten dokumentieren.
Insbesondere da die Merkmale des neuen Coronavirus zu Beginn der Pandemie schnell katalogisiert wurden, wurde wenig unternommen, um sie mit geeigneten Kontrollgruppen zu vergleichen. Neuere Forschungen haben COVID-19 in den Kontext der breiteren Intensivpflegelandschaft gestellt.
Metkus und Kollegen verglichen die Troponinerhöhung bei akutem Atemnotsyndrom (ARDS) mit COVID-19 mit ARDS bei Nicht-COVID-19 bei fast 250 intubierten Patienten in einem großen Krankenhaussystem und zeigten, dass Myokardverletzungen bei COVID-19 tatsächlich seltener auftraten als bei Nicht -COVID-19- ARDS -COVID-19 ARDS-Patienten unter Berücksichtigung des Schweregrads der kritischen Erkrankung und der Organfunktionsstörung. Bei COVID-19-Patienten war die Sauerstoffversorgung und Hämodynamik schlechter, was eine indirekte Herzschädigung infolge einer kritischen Erkrankung als wahrscheinlichsten Mechanismus vermuten lässt.
Diese Ergebnisse werden durch die hohen Raten von Myokardschäden untermauert, die bei anderen systemischen Infektionen als COVID-19, einschließlich Sepsis, beobachtet werden und in der Fachliteratur zur Intensivpflege dokumentiert sind.]
Während andere kardiale Manifestationen wie Myokarditis, Stresskardiomyopathie und Myokardinfarkt bei COVID-19 beschrieben wurden und nicht außer Acht gelassen werden sollten, hat die Einbeziehung von COVID-19 in den Kontext anderer kritischer Erkrankungen unser Verständnis der Verletzung neu kalibriert. Myokard, um häufigere Mechanismen wie Hypoxämie und hämodynamische Beeinträchtigungen zu erkennen.
Obwohl eine Myokardschädigung bei COVID-19 möglicherweise nicht nur auf das Virus zurückzuführen ist, weist das Ausmaß der kritischen Erkrankung, die es verursachen kann, auf einzigartige pathogene Eigenschaften hin.
Der dafür verantwortliche Mechanismus hängt wahrscheinlich mit seiner Fähigkeit zusammen, eine starke Entzündungsreaktion auszulösen . In Studien zu Myokardschäden bei COVID-19 zeigten Prädiktoren für einen Troponin-Anstieg durchweg Assoziationen mit Entzündungsmarkern, einschließlich C-reaktivem Protein (CRP), D-Dimer, Ferritin und Fibrinogen. Pathologische Studien haben diesen Zusammenhang gestützt, indem sie eine erhöhte Zytokinexpression bei höherer Viruslast zeigten.
Während die hyperinflammatorische Phase einen Großteil der Atemwegs- und Kreislaufbeeinträchtigung verursacht, die bei schweren Infektionen zu indirekten Myokardschäden führt, war früher bekannt, dass Entzündungen direkt Herz-Kreislauf-Erkrankungen vermitteln, wie sie bei Atherosklerose und anderen hyperinflammatorischen Zuständen, einschließlich Sepsis und hämophagozytischer Lymphohistiozytose (HLH), beobachtet werden.
Kardiomyozyten exprimieren Zytokinrezeptoren, einschließlich Tumornekrosefaktor und Interleukin-6, deren Wirkung die Inotropie infolge von Veränderungen in der Katecholaminsignalisierung verringern und zytotoxische Schäden verursachen kann. Darüber hinaus verändern Zytokine das Gefäßendothel, um die Entzündungsmigration zu fördern, und können Endothelitis, Mikrothromben und mikrovaskuläre Verletzungen verursachen, die bei COVID-19 beschrieben wurden.
Die Echokardiographie hat unser Verständnis von Myokardschäden bei COVID-19 weiter verfeinert und bestimmte funktionelle Verletzungsmuster detailliert beschrieben . Szekely et al. fanden heraus, dass eine rechtsventrikuläre (RV) Dysfunktion die häufigste echokardiographische Anomalie in einer Reihe von 100 hospitalisierten Patienten mit COVID-19 war, nämlich bei fast 40 %, wobei die RV-Verschlechterung am häufigsten mit klinischen Dekompensationen einherging. RV-Dysfunktion war auch die häufigste Anomalie, die in einer multizentrischen internationalen Kohorte von mehr als 300 hospitalisierten Patienten mit COVID-19 beobachtet wurde, etwa 26 %.
In beiden Studien wurde jedoch das gesamte Funktionsspektrum beobachtet, einschließlich globaler und regionaler linksventrikulärer (LV) systolischer Dysfunktion, diastolischer Dysfunktion und Perikardergüssen. Die Prävalenz der RV-Dysfunktion weist darauf hin, dass COVID-19 ein überwiegend respiratorischer Krankheitserreger mit einer Neigung zu tiefen Venenthrombosen und Lungenembolien ist, die alle den Lungengefäßwiderstand beeinträchtigen und die RV-Belastung erhöhen können.
Troponin-Erhöhung: prognostische Implikationen
Abgesehen vom Verletzungsmechanismus hat eine nachweisbare Troponinerhöhung einen prognostischen Wert bei einer akuten COVID-19-Infektion. Shi und seine Kollegen gehörten zu den ersten, die über eine erhöhte Sterblichkeit bei Patienten mit erhöhtem Troponin aus einer monozentrischen Kohorte in Wuhan berichteten und dabei ein drei- bis vierfaches Sterberisiko feststellten.
Anschließend haben Lombardi et al. Sie validierten diese Ergebnisse in einer multizentrischen Kohorte in Italien mit mehr als 600 Patienten, allerdings mit einer abgeschwächten Hazard-Ratio von 1,7. In einer der vielfältigsten untersuchten Kohorten mit mehr als 2000 Patienten, die in ein New Yorker Krankenhaussystem eingeliefert wurden, haben Smilowitz et al. Sie zeigten, dass das Sterberisiko bei Patienten mit Troponin-Erhöhung doppelt so hoch war.
Wichtig ist, dass der Grad der Troponinerhöhung mit einer schwereren kritischen Erkrankung (definiert als Aufnahme auf die Intensivstation, Notwendigkeit einer mechanischen Beatmung oder Tod) verbunden war.
Während diese wegweisenden Studien einen Troponin-Anstieg als größer als das 99. Perzentil der Obergrenze des Normalwerts definierten, zeigten Qin und Kollegen, dass ein Troponin-Anstieg bei einer COVID-19-Infektion selbst bei niedrigen Schwellenwerten mit der Mortalität verbunden war. 19 bis 50 % niedriger als die traditionell in Einrichtungen verwendeten Werte.
Darüber hinaus scheint das Risiko von Mortalität und unerwünschten Folgen mit dem Grad der Troponin-Erhöhung kontinuierlich zu sein; Ein höherer Troponinspiegel erhöht weiterhin das Risiko und bietet Ärzten eine quantitative und nicht nur qualitative Risikobewertung für Patienten. Daher wurde die Troponinmessung für Krankenhauspatienten mit COVID-19 in die routinemäßige klinische Praxis und Managementalgorithmen integriert.
Im Falle von Krankenhäusern dient es dazu, die Entwicklung vorherzusagen und Patienten zu identifizieren, die möglicherweise intensivere Ressourcen benötigen, insbesondere in Zeiten des Mangels. Mehrere Richtlinien der Gesellschaft, darunter die Weltgesundheitsorganisation und die chinesische klinische Leitlinie für COVID-19, empfehlen die Troponinmessung bei allen aufgenommenen Patienten, während andere, darunter das American College of Cardiology (ACC), Tests empfehlen, wenn klinisch angezeigt.
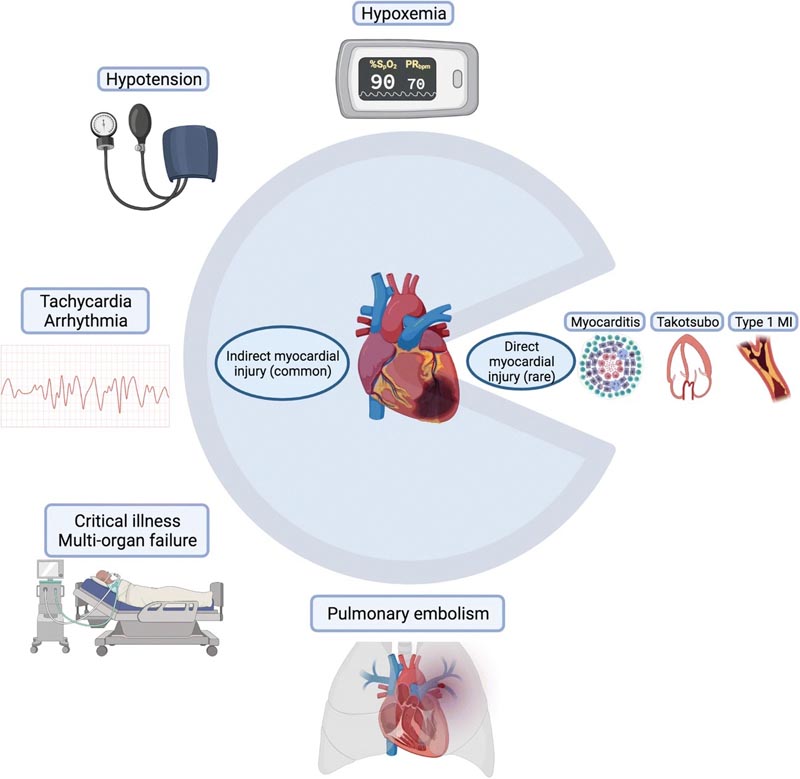
Symbolisches Kreisdiagramm, das häufige Ursachen für indirekte Myokardschäden und seltenere Ursachen für direkte Myokardschäden bei einer COVID-19-Infektion veranschaulicht
Rolle der kardialen Magnetresonanz (CMR)
Die pathophysiologische Plausibilität, dass COVID-19 eine direkte Myokardinfektion verursacht, und frühe Fallberichte, die auf eine Myokarditis hinwiesen, führten zu einem erhöhten Interesse am Einsatz von CMR, heute die bevorzugte nicht-invasive Diagnosemethode für akute Myokarditis. Frühe Fallberichte über Myokarditis bei akuter COVID-19-Infektion berichteten von einer Prävalenz von etwa 7 %; Diese Studien waren jedoch aufgrund inkonsistenter diagnostischer Kriterien und begrenzter Stichprobengrößen fehlerhaft.
Wie oben im Zusammenhang mit histopathologischen Studien erläutert, gilt die Prävalenz von Myokarditis bei COVID-19 mittlerweile als äußerst selten und in größeren retrospektiven multizentrischen Kohortenstudien wurde festgestellt, dass sie 1 % oder weniger beträgt.
Das Erkennen der geringen Wahrscheinlichkeit einer COVID-19-Myokarditis vor dem Test und die Berücksichtigung der wahrscheinlichsten Ursachen einer Myokardschädigung geben Aufschluss über den angemessenen Einsatz von CMR. Insbesondere bei CMR erhöhen die längere Scanzeit und die Logistik, die für Untersuchungen bei intubierten Patienten erforderlich sind (einschließlich Patienten, die auf und von scannersicheren Beatmungsgeräten umsteigen), das Expositionsrisiko für medizinisches Personal.
Teil II: Behobene COVID-19-Infektion
und Rückkehr zum Spielbetrieb für Sportler
Die Frage, wann ein Leistungssportler nach einer COVID-19-Infektion wieder spielen kann (RTP), stellt die Kardiologie vor eine dringende und wichtige Herausforderung. Die Dringlichkeit ergibt sich aus der Tatsache, dass Sportorganisationen, vom Profi- bis zum Freizeitsport, zu den ersten gehörten, die während der Pandemie mit voller Kraft zurückkamen. Dieser kollektive Ansturm auf die Rückkehr begann mit wenigen Daten darüber, wie man nach einer Infektion sicher zurückkehren kann.
Die Bedeutung war klar, da Myokarditis eine mögliche Folge einer COVID-19-Infektion und eine Todesursache bei jungen Sportlern ist. Sportliche Betätigung bei aktiver Myokarditis kann zu verstärkter Entzündung und einem proarrhythmogenen Milieu führen. Darüber hinaus kann das sportliche Herz Anomalien in Größe, Funktion und Reaktion auf körperliche Betätigung aufweisen, die es schwierig machen, es vom entzündeten oder verletzten Herzen zu unterscheiden.
Intensives Training kann zu einem vorübergehenden Anstieg der Troponine und zu bildgebenden Befunden führen, die auf Herzermüdung und Myokardentzündung hinweisen. Da Tausende von Sportlern darauf brennen, wieder aktiv zu werden, wurde die Frage, wie man dies sicher tun kann, während der Pandemie zu einem zentralen Thema auf dem Gebiet der Kardiologie.
Im Mai 2020 gab die ACC-Abteilung für Sport- und Bewegungskardiologie ihre ersten RTP-Empfehlungen heraus. Den Sportlern, bei denen eine symptomatische Infektion auftrat, empfahlen sie eine zweiwöchige Ruhephase nach Abklingen der Symptome, eine kardiale Untersuchung (Elektrokardiogramm, Echokardiogramm oder hochempfindliches Troponin) und eine zusätzliche kardiale Bildgebung bei etwaigen Anomalien.
Wenn eine Myokarditis festgestellt wurde, wurden die Ärzte auf die bestehenden Myokarditis-Richtlinien der American Heart Association (AHA)/ACC verwiesen, die einen Verzicht auf Sport für 3–6 Monate empfehlen . Sechs Monate später aktualisierte und erweiterte die Sektion diese Richtlinien um spezifische altersbezogene Empfehlungen und detaillierte Empfehlungen für Troponin- und CMR-Screenings. Es folgte eine Experten-Konsenserklärung, in der von der Verwendung eines CMR-basierten Screenings bei allen Sportlern mit einer früheren COVID-19-Infektion abgeraten wurde.
Glücklicherweise zeigen die neuesten Registrierungsdaten, dass das nationale RTP ein sicheres Unterfangen war. Eine Studie mit 789 Profisportlern, die sich nach einer COVID-19-Infektion einem RTP-Herztestprotokoll unterzogen, ergab bei 5 Athleten (0,6 %) bildgebende Hinweise auf eine entzündliche Herzerkrankung. Das Herz-Screening-Protokoll umfasste Troponin, EKG und transthorakales Echokardiogramm; Eine CMR oder Belastungsechokardiographie wurde nur bei Sportlern mit einem auffälligen anfänglichen Herz-Screening durchgeführt.
Bei Sportlern, die sich einem Herztest unterzogen und wieder zum Spiel zurückkehrten, traten keine unerwünschten kardialen Ereignisse auf.
Einen Patienten nach einer COVID-19-Infektion bei der Rückkehr zum Sport zu begleiten, ist ein herausfordernder Prozess. Die Daten zu COVID-19 entwickeln sich rasant weiter, die Sportkardiologie ist ein relativ junges Fachgebiet und das sportliche Herz ein einzigartiges Substrat. Dies führt insgesamt zu mehr Unsicherheit als zu klaren Antworten, wenn die Rückkehr ins Spiel näher rückt. Da jedoch die Zeit vergangen ist und immer mehr Daten vorliegen, kann diese Rückgabe, wenn man sich an den aktuellen Screening-Empfehlungen orientiert, sicher erfolgen.
langes COVID
Während Mitarbeiter und Forscher im Gesundheitswesen weiterhin über die akuten kardiovaskulären Risiken von COVID-19 lernen, diese klassifizieren und behandeln, werden viele ambulante Anbieter von Patienten mit anhaltenden Symptomen nach einer akuten Infektion, in den populären Medien als „Long COVID“ bekannt , überschwemmt . ”
Mit zunehmender Anerkennung dieses Syndroms haben Forscher die folgenden Definitionen aufgestellt:
- Postakutes COVID-Syndrom (PACS) bei anhaltenden Symptomen nach 3 Wochen.
- Chronisches COVID-Syndrom: nach 12 Wochen.
Die National Institutes of Health haben auch „Long COVID“ als postakute Folgen einer SARS-CoV-2-Infektion (PASC) bezeichnet . Die gemeldeten Symptome umfassen ein breites Spektrum kardiopulmonaler und neurologischer Beschwerden, darunter Müdigkeit, Herzklopfen, Brustschmerzen, Atemnot, geistige Verwirrung und Dysautonomie.
Während frühe Studien die Prävalenz von Long-COVID auf 30 bis 80 % schätzten, waren sie durch einen primären Fokus auf Krankenhauspatienten begrenzt. Von einer nicht hospitalisierten Kohorte von 272 Personen in den USA gaben 35 % an, 14–21 Tage nach der COVID-19-Diagnose nicht den Ausgangswert erreicht zu haben.
Neue Studien nutzen mobile Technologie, um es Ersthelfern zu ermöglichen, ihre Symptome direkt zu überwachen und zu melden, um sowohl akute als auch langfristige Symptome zu verfolgen. Während bei älteren Menschen mit mehreren Komorbiditäten ein höheres Risiko für langes COVID besteht, berichteten etwa 20 % der jüngeren Menschen im Alter von 18 bis 34 Jahren und ohne komorbide Erkrankungen auch nach 14 bis 21 Tagen weiterhin über anhaltende Symptome.
Bezüglich spezifischer kardiovaskulärer Symptome berichteten nach 60 Tagen etwa 20 % der Personen über Brustschmerzen und 14 % über Herzklopfen. Es wird angenommen, dass Entzündungen und ein erhöhter Stoffwechsel- und Myokardbedarf zum Fortbestehen von Herz-Kreislauf-Symptomen beitragen, wie dies auch bei anderen schweren Coronavirus-Infektionen wie SARS beobachtet wurde.
Eine wachsende Zahl von Patienten und Fallstudien stellen auch einen Zusammenhang zwischen COVID-19 und dem posturalen orthostatischen Tachykardie-Syndrom (POTS) fest. POTS ist durch Veränderungen der Herzfrequenz mit Positionsänderungen gekennzeichnet, oft begleitet von Herzklopfen und verminderter Belastungstoleranz. POTS wurde bereits früher mit postviralen Erkrankungen in Verbindung gebracht, der genaue Mechanismus ist jedoch unbekannt.
Eine Hypothese, die POTS mit COVID-19 in Verbindung bringt, basiert auf seiner bekannten Wechselwirkung mit dem in Neuronen exprimierten ACE2-Protein. Die Forscher gehen davon aus, dass dies die normale ACE2-vermittelte Blutdruckregulation stören und zu Hypotonie und Dysautonomie führen kann. Die Behandlung von POTS und Dysautonomie konzentriert sich hauptsächlich auf Bildung, Bewegung sowie Salz- und Flüssigkeitsersatz. Wirkstoffe wie Midodrin können den Gefäßtonus verbessern, während Betablocker und Ivabradin helfen können, Herzklopfen zu kontrollieren.
Da 20–30 % der ambulanten Patienten und bis zu 80 % der hospitalisierten Patienten anhaltende Symptome aufweisen, liegt es nun in der Verantwortung von Anbietern und Forschern, die anhaltende Belastung durch die COVID-19-Infektion zu erkennen und zu bewältigen. Viele erholen sich durch vorausschauende Anleitung und leichte Übungen langsam von selbst.
Allerdings hat die British Thoracic Society Richtlinien für die Nachuntersuchung aller Patienten unabhängig vom Schweregrad nach 12 Wochen mit einer Röntgenaufnahme des Brustkorbs und einer klinischen Untersuchung aufgestellt, um die Notwendigkeit weiterer Tests zu beurteilen.
Personen mit schwerer COVID-19-Erkrankung wird empfohlen, die Nachuntersuchung bereits nach 4 bis 6 Wochen durchzuführen, um die Notwendigkeit weiterer Tests und einer multidisziplinären Rehabilitation zu beurteilen. Serielle Elektrokardiogramme und Echokardiogramme können zur Überwachung von Menschen mit anhaltenden Herzsymptomen verwendet werden, obwohl eine erweiterte Bildgebung im Einzelfall analysiert werden sollte.
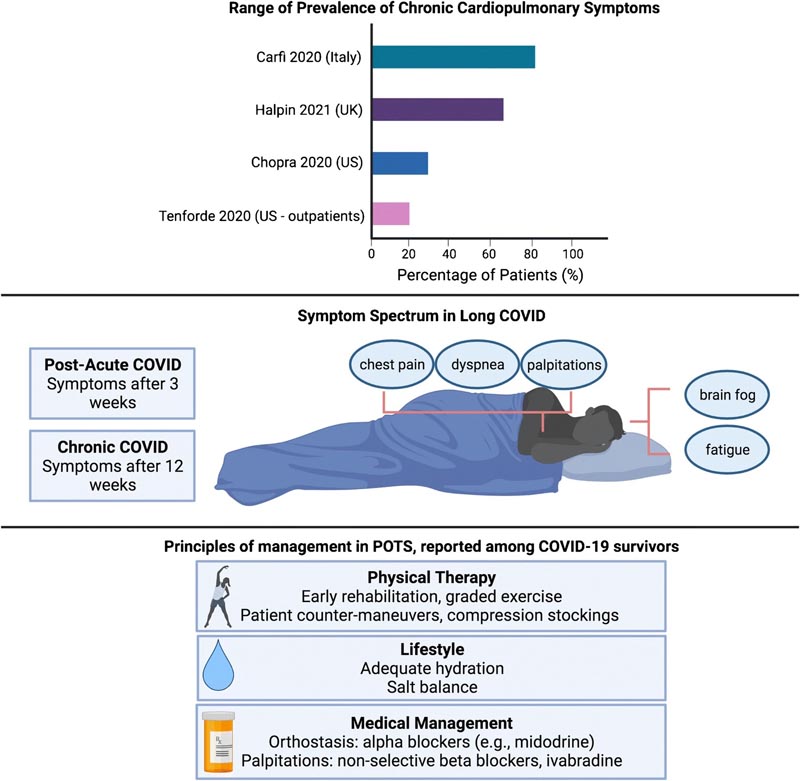
Überprüfung der Prävalenz von Long-COVID, Definitionen und symptomatischer Manifestationen sowie aktueller Behandlungsprinzipien für mögliche Überschneidungen von COVID/posturalem orthostatischem Tachykardie-Syndrom
Abschluss Es ist schon einige Zeit her, dass die weltweite medizinische Gemeinschaft mit einer neuen Krankheit pandemischen Ausmaßes konfrontiert wurde. Die Aufklärung der Geheimnisse von COVID-19 war eine Übung sorgfältiger Wissenschaft und Experimente. Die neuesten Beobachtungs-, Pathologie-, Bildgebungs- und klinischen Studien haben die kurz- und langfristigen Auswirkungen von COVID-19 auf das Herz-Kreislauf-System verdeutlicht und unser Verständnis auf verschiedene Weise aktualisiert. Eine Myokardschädigung bei COVID-19 scheint überwiegend durch die Schwere der kritischen Erkrankung und nicht durch eine direkte Myokardschädigung durch Viruspartikel verursacht zu werden. Während eine Myokardschädigung nicht nur bei COVID-19 auftritt und an anderer Stelle in der Literatur zur Intensivpflege bei Sepsis und ARDS beobachtet wird, ist die durch COVID-19 ausgelöste hyperinflammatorische Reaktion ein einzigartiges Kennzeichen und kann zu schwereren klinischen Verläufen führen. im Vergleich zu anderen Viren beobachtet. Wenn überhaupt, hat COVID-19 das entscheidende Zusammenspiel zwischen Entzündungen und Herz-Kreislauf-Erkrankungen verstärkt und dürfte die zukünftige Arbeit auf diesem Gebiet vorantreiben. Während Myokardschäden in Form einer Troponin-Erhöhung bei einer akuten COVID-19-Infektion weit verbreitet und prognostisch sind, deuten neuere Studien darauf hin, dass die Troponin-Erhöhung eher ein Marker für die Schwere der Erkrankung und das zugrunde liegende Substrat als ein Mediator ist. unabhängig von den Ergebnissen. Obwohl die CMR nach wie vor ein wirksames Instrument zur Diagnose einer akuten Myokarditis ist, sollte sie angesichts der in bisherigen Studien ermittelten niedrigen Ausgangsprävalenz sowie des Risikos einer Exposition des Gesundheitspersonals mit Vorsicht eingesetzt werden. Es sind Studien erforderlich, um die klinische Relevanz der anhaltenden Entzündungssignale bei Überlebenden zu verstehen und wie diese mit denen verglichen oder gegenübergestellt werden können, die sich von anderen häufigen Viren oder kritischen Krankheiten erholen. Das RMC könnte eine stärker fokussierte Rolle bei der Bereitstellung von Empfehlungen für gefährdete Bevölkerungsgruppen wie Sportler spielen; Allerdings sollte es sich selten um die Erstlinienmethode handeln und bildgebende Befunde allein sollten nicht als Grundlage für die Diagnose einer akuten Myokarditis dienen. Da wir schließlich in eine neue Ära des Überlebens eintreten, ist zusätzliche Forschung erforderlich, um die Belastung durch anhaltende kardiopulmonale Symptome zu katalogisieren, die erhebliche Auswirkungen auf das Wohlbefinden der Patienten und die globale Wirtschaft hinsichtlich der Fähigkeit zur Rückkehr an den Arbeitsplatz haben. Es sind auch Forschungsarbeiten erforderlich, um zu bestätigen, ob bestehende Therapien für Dysautonomie, einschließlich POTS, in der Long-COVID-Population wirksam sind und wie eine akute Behandlung die Wahrscheinlichkeit und Prävalenz dieses chronischen Syndroms verändern kann. Während Fragen zu COVID-19 und CV-Erkrankungen bestehen bleiben und weiterhin auftauchen werden, hat die Pandemie gezeigt, dass die wissenschaftliche Gemeinschaft in einzigartiger Weise engagiert und in der Lage ist, diese entscheidenden Antworten zu geben. |