La thrombocytopénie est définie comme une numération plaquettaire < 150 × 10 9 /L et survient fréquemment chez les patients gravement malades.
La condition résulte d’une production réduite ou d’une destruction ou d’une consommation accrue de plaquettes.
La thrombocytopénie chez les patients gravement malades est souvent la conséquence de multiples mécanismes physiopathologiques. Ceux-ci doivent être identifiés si l’on veut déterminer le pronostic et fournir un traitement approprié.
Cet article donne un aperçu de la thrombocytopénie chez les patients gravement malades, y compris ses mécanismes physiopathologiques, son évolution, son évaluation et son traitement. Le travail est basé sur la littérature identifiée grâce à une recherche non systématique dans la base de données PubMed et sur la propre expérience clinique des auteurs.
| Prévalence et définition |
Dans une étude clinique récente portant sur des patients hospitalisés dans des unités de soins intensifs et d’observation, la thrombocytopénie a été définie comme légère (100-149 × 10 9 /L), modérée (51-99 × 10 9 /L) ou sévère (<50 × 10 9 /L). /L), avec des incidences signalées de 15,3 %, 5,1 % et 1,6 %, respectivement. L’incidence de la thrombocytopénie d’apparition récente chez les patients en soins intensifs varie de 14 % à 44 %. Plus de la moitié des personnes qui passent plus de deux semaines en soins intensifs développent une thrombocytopénie, associée à une mortalité élevée.
| Mécanismes physiopathologiques |
Les plaquettes sont produites dans la moelle osseuse à partir des mégacaryocytes, ont une durée de vie de 8 à 10 jours et sont détruites principalement dans la rate. Ils sont essentiels à l’hémostase et contribuent également à l’angiogenèse et à l’immunité innée.
Les causes de la thrombocytopénie peuvent être divisées en trois catégories principales : une production réduite, une destruction accrue et une consommation accrue de plaquettes. Un seul patient peut souvent présenter simultanément plusieurs de ces mécanismes physiopathologiques ( Figure 1 ). Le dysfonctionnement plaquettaire est relativement fréquent chez les patients gravement malades et peut être dû à une urémie, une insuffisance hépatique ou à l’utilisation de médicaments ou d’une machine cœur-poumon.
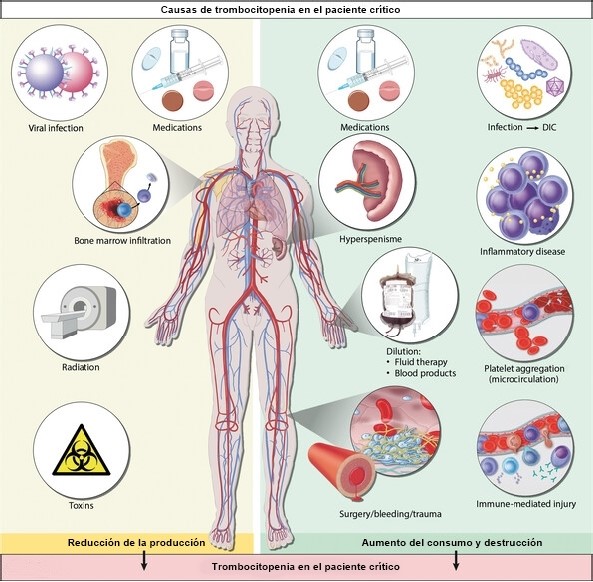
Figure 1. La thrombocytopénie est fréquente chez les patients gravement malades et résulte souvent de plusieurs mécanismes physiopathologiques différents. Les causes peuvent être divisées en trois catégories principales : diminution de la production de plaquettes (maladie de la moelle osseuse, recours à la chimiothérapie ou à la radiothérapie, infections virales aiguës et chroniques et intoxications) ; augmentation de la consommation de plaquettes (activation physiologique des plaquettes lors d’une intervention chirurgicale/d’un traumatisme/d’un saignement, activation pathologique des plaquettes comme dans les cas de coagulation intravasculaire disséminée (CIVD), qui est le plus souvent déclenchée par une infection/une septicémie grave) et augmentation de la destruction des plaquettes (hypersplénisme, médicament à médiation immunologique réactions d’hypersensibilité et formation d’autoanticorps, maladies inflammatoires, telles que la lymphohistiocytose hémophagocytaire et l’agrégation plaquettaire dans la microcirculation, comme dans les cas de microangiopathie thrombotique). De plus, une thrombocytopénie peut survenir à la suite d’un effet de dilution consécutif à une transfusion massive de liquides ou de produits sanguins.
> Réduction de la production
On ne sait pas clairement dans quelle mesure une production réduite de plaquettes contribue à la thrombocytopénie chez les patients gravement malades. Les personnes ayant subi une chimiothérapie cytotoxique présentent une production réduite, tout comme celles souffrant d’une maladie de la moelle osseuse ou d’une intoxication alcoolique aiguë. Les infections virales aiguës et chroniques, notamment l’hépatite C, le cytomégalovirus, le virus Epstein-Barr et le parvovirus B19, peuvent inhiber la production de plaquettes. Une thrombocytopénie a également été décrite chez des patients atteints de formes sévères de COVID-19.
> Augmentation de la consommation
Les plaquettes peuvent être activées par les leucocytes, le système du complément, les facteurs de coagulation, les micro-organismes et les lésions tissulaires. Ils jouent également un rôle clé dans la réponse immunitaire. L’activation plaquettaire médiée par la thrombine peut être physiologique, par exemple en réponse à une intervention chirurgicale majeure, à un traumatisme ou à une perte de sang. L’activation pathologique des plaquettes se produit en cas de coagulation intravasculaire disséminée (CIVD), qui peut être déclenchée, par exemple, par une septicémie ou une tumeur maligne. Les plaquettes activées sont rapidement éliminées de la circulation, entraînant une thrombocytopénie. Les patients recevant un traitement d’oxygénation extracorporelle par membrane présentent également une consommation accrue de plaquettes.
> Une plus grande destruction
Plus de 50 % des cas de thrombocytopénie chez les patients gravement malades sont le résultat d’un sepsis ou d’une infection grave.
Il a été rapporté que les médicaments antiplaquettaires et les antibiotiques provoquent des effets indésirables à médiation immunitaire pouvant conduire à une thrombocytopénie. Ensemble, ils représentent environ 15 % des cas dans les services de réanimation. La formation d’anticorps peut également provoquer une thrombocytopénie.
L’exemple le plus courant est la formation d’anticorps contre le complexe héparine-facteur plaquettaire 4 (PF4) ; Ces anticorps provoquent une thrombocytopénie induite par l’héparine (TIH) lorsque les héparines sont utilisées comme anticoagulants. Cependant, cela est relativement rare et est rapporté chez <5 % des patients atteints de thrombocytopénie dans les unités de soins intensifs.
| Bilan, diagnostic et évolution clinique |
La cause sous-jacente de la thrombocytopénie peut souvent être identifiée en prenant des antécédents médicaux complets, en surveillant l’évolution clinique et en effectuant des tests de diagnostic de laboratoire spécifiques. Chez environ 25 % des patients gravement malades atteints de thrombocytopénie, la maladie a plus d’une cause sous-jacente ( Figure 1 ).
Il est essentiel d’obtenir un aperçu des antécédents médicaux, des comorbidités et des médicaments du patient, puis de visualiser l’état clinique actuel à la lumière de ces informations. Il convient de tenter de déterminer si la thrombocytopénie est le résultat de la maladie grave actuelle et du dysfonctionnement d’un organe associé, ou si elle fait partie d’une affection sous-jacente préexistante, telle qu’une hémopathie maligne grave.
La numération plaquettaire absolue doit également être prise en compte, ainsi que l’évolution et l’évolution de la thrombocytopénie. Des modèles spécifiques deviendront souvent évidents et peuvent révéler la cause sous-jacente ( Tableau 1 ). En général, la thrombocytopénie sera plus sévère (< 50 x 10 9 /L) si une cause sous-jacente chronique s’accompagne de nouveaux facteurs étiologiques supplémentaires ; la transfusion de plaquettes peut alors ne pas parvenir à augmenter la numération plaquettaire. En raison du renouvellement élevé des plaquettes, un faible nombre de plaquettes en cas de maladie grave présente probablement un risque hémostatique plus faible que la thrombocytopénie causée par une insuffisance médullaire.
Il est également important de connaître d’autres facteurs pouvant contribuer à une faible numération plaquettaire. Les exemples incluent la pseudothrombocytopénie due à l’agrégation plaquettaire induite par l’EDTA, l’hémodilution due à une perfusion de liquide, les transfusions massives d’autres composants sanguins sans plaquettes ou l’accumulation de plaquettes dans la rate en cas de splénomégalie ou de maladie du foie avec hypertension portale. Les patients atteints de thrombocytopénie qui développent une maladie thromboembolique doivent être testés pour des conditions procoagulantes.
| Cours clinique | cause probable |
| La numération plaquettaire est faible et reste faible | Insuffisance médullaire Hypersplénisme |
| La numération plaquettaire diminue rapidement, puis se normalise rapidement | Chirurgie Utilisation d’un appareil de circulation extracorporelle Transfusions massives sans plaquettes |
| Diminution progressive et normalisation de la numération plaquettaire à mesure que l’état clinique s’améliore | Septicémie Pancréatite Conditions inflammatoires |
| La numération plaquettaire diminue et reste faible malgré l’amélioration clinique du patient | Thrombocytopénie médicamenteuse |
| La numération plaquettaire diminue et reste faible chez les patients présentant une défaillance organique persistante | Septicémie Coagulation intravasculaire disséminée (CIVD) Insuffisance circulatoire |
Tableau 1. Evolutions cliniques typiques de la thrombocytopénie chez les patients gravement malades et causes sous-jacentes possibles.
| Traitement |
Chez les patients gravement malades, une thrombocytopénie ou une baisse rapide du nombre de plaquettes sont des marqueurs de mauvais pronostic et d’un risque accru de mortalité.
L’affection sous-jacente du patient doit être traitée. Le contrôle des infections et le traitement de soutien aux organes doivent être prioritaires si la thrombocytopénie est causée par un sepsis, tandis que l’hémostase et les transfusions sanguines sont appropriées si la thrombocytopénie est le résultat d’une hémorragie massive.
Fournir le traitement correct dépend de l’identification des causes. La transfusion de plaquettes peut être l’approche correcte chez les patients présentant des affections qui réduisent la production ou augmentent la consommation/destruction des plaquettes, mais peut être potentiellement nocive dans les affections où il y a une activation intravasculaire accrue, comme la thrombocytopénie induite par l’héparine, le purpura thrombocytopénique thrombotique ou le purpura prothrombotique disséminé. coagulation intravasculaire.
La transfusion de plaquettes peut également augmenter le risque d’infections nosocomiales et de lésions pulmonaires (aiguës) liées à la transfusion.
Ces facteurs justifient une approche conservatrice du recours aux transfusions de plaquettes, en mettant davantage l’accent sur le traitement de l’affection sous-jacente.
> Transfusion thérapeutique
Pour éviter une thrombocytopénie grave et une hémodilution des facteurs de coagulation, les saignements sévères doivent être traités par une transfusion équilibrée de globules rouges, de plasma et de plaquettes. Selon les directives internationales, la transfusion de plaquettes doit être envisagée chez les patients gravement malades présentant des saignements et une numération plaquettaire < 50 x 10 9 /L, ou chez lesquels une fonction plaquettaire réduite est suspectée/confirmée.
> Transfusion prophylactique
La raison la plus courante pour laquelle des transfusions de plaquettes sont administrées à des patients gravement malades est de prévenir les saignements.
La pratique clinique varie considérablement, mais les directives internationales recommandent la transfusion de plaquettes si le nombre de plaquettes est < 10 x 10 9 /L. On estime que la transfusion augmente la numération plaquettaire d’environ 15 x 10 9 /L par unité transfusionnelle, bien que cela puisse varier dans une mesure relativement importante.
> Transfusion liée aux procédures
La transfusion de plaquettes est recommandée pour minimiser le risque de saignement lors de certaines procédures, par exemple lors de l’implantation d’un cathéter veineux central chez les patients ayant une numération plaquettaire < 20 x 10 9 /L. De même, il existe des lignes directrices et des recommandations pour la numération plaquettaire absolue chez les patients subissant une ponction lombaire ou une anesthésie péridurale (> 50 x 10 9 /L), une intervention chirurgicale majeure (> 50 x 10 9 /L) ou une neurochirurgie (> 100 x 10 9 / L). Cependant, ces recommandations reposent en grande partie sur l’expérience clinique et la base de données probantes est limitée.
> Autres méthodes de traitement
Les médicaments peuvent affecter la production et la destruction des plaquettes. Chez les personnes gravement malades, des stéroïdes peuvent être administrés si l’on soupçonne qu’une faible numération plaquettaire est d’origine immunologique.
Conclusions
|















