| Einführung |
Eosinophile sind multifunktionale Leukozyten, normale Bestandteile des Magen-Darm-Trakts, außer wenn sie im Plattenepithel der Speiseröhre vorhanden sind.
Homöostatische Eosinophile befinden sich hauptsächlich in der Lamina propria des Dünndarms und schützen vor Parasiten und pathogenen Bakterien. Diese Zellen reagieren selektiv auf Parasiten und ermöglichen es einigen, sich in der Schleimhaut anzusiedeln, wodurch sie das Darmmikrobiom regulieren und an der Gewebehomöostase beteiligt sind.
Eosinophile modulieren auch die Immunantwort durch die Sekretion von Zytokinen, die dendritische Zellen aktivieren und einen IgA-Klassenwechsel in B-Zellen induzieren können. In ihrer homöostatischen Funktion sind Eosinophile gleichmäßig und spärlich in der Lamina propria verteilt und bilden keine Cluster oder unterliegen einer Degranulation.
Im Dünndarm halten Eosinophile die IgA-Konzentration durch sekretorische Faktoren aufrecht, die das Überleben von IgA-sekretierenden Plasmazellen verlängern und die Produktion von sekretorischem IgA induzieren.
Dieses Immunglobulin ist eine wichtige erste Verteidigungslinie in der Schleimhaut und verhindert das Eindringen pathogener Mikroorganismen, indem es diese mit einer hydrophilen Hülle umhüllt, die vom Schleimhautepithel abgestoßen wird und so deren Ausstoß ermöglicht.
Sowohl Gewebe- als auch periphere Eosinophilie sind seit langem als Anzeichen einer Parasiteninvasion bekannt, und wie jeder Pathologe weiß, ist es gut, das Prinzip „Sehen Sie Eosinophile, denken Sie an Parasiten“ im Auge zu behalten, wenn Eosinophile in der Magen-Darm-Schleimhaut vorherrschen .
Sein übermäßiges Vorkommen ist nicht vorteilhaft, wie etwa bei Asthma und eosinophilen Magen-Darm-Erkrankungen, bei denen die Rekrutierung von Eosinophilen durch Krankheitserreger oder Allergene induziert wird, was zu Epithelschäden führt.
Bei Asthma sind die Phänotypen der verschiedenen Erkrankungen klar und die Manifestation der Erkrankung hängt nicht nur von einem direkten Zusammenhang mit der Anzahl der Eosinophilen ab, sondern auch von der Wechselwirkung zwischen genetischer Veranlagung und dem Mikrobiom.
Bei eosinophilen Erkrankungen des Gastrointestinaltrakts ist diese Wechselwirkung weniger bekannt, mit Ausnahme der eosinophilen Ösophagitis, die durch eine Eosinophilie der Plattenepithelschleimhaut gekennzeichnet ist und bei der eine ähnliche Wechselwirkung zwischen Genetik, Mikrobiom und Allergenen (insbesondere Nahrungsmitteln) nachgewiesen wurde.
Zu den primären eosinophilen Erkrankungen zählen eosinophile Ösophagitis, Gastroenteritis und Kolitis. Eine gastrointestinale Beteiligung kann auch beim hypereosinophilen Syndrom beobachtet werden.
Es gibt zahlreiche sekundäre Ursachen für gastrointestinale Eosinophilie, darunter Nahrungsmittelüberempfindlichkeit, Arzneimittelreaktionen, Parasitenbefall und bösartige Tumoren, die häufiger vorkommen als primäre eosinophile Erkrankungen.
Auch andere Magen-Darm-Erkrankungen sind durch eine erhöhte Anzahl eosinophiler Granulozyten gekennzeichnet, beispielsweise die gastroösophageale Refluxkrankheit und die entzündliche Darmerkrankung.
Klassifizierung von Magen-Darm-Erkrankungen im Zusammenhang mit Eosinophilen Primäre eosinophile Erkrankungen. • Eosinophile Ösophagitis Sekundäre eosinophile Infiltration bei Krankheiten . • Infektion: z. B. eine Parasiten- oder Helicobacter-pylori- Magen-Darm-Erkrankungen, die mit einem Anstieg der Eosinophilen einhergehen • Funktionelle Dyspepsie. |
Diese Übersicht konzentriert sich auf die weniger untersuchten eosinophilen Magen-Darm-Erkrankungen wie Gastroenteritis und Kolitis sowie auf die kürzlich beschriebene duodenale Eosinophilie im Zusammenhang mit funktioneller Dyspepsie und die fokale eosinophile Kolitis im Zusammenhang mit Kolon-Spirochetose.
Alle diese eosinophilen Magen-Darm-Erkrankungen sind durch einen Überschuss an Eosinophilen in der Schleimhaut, Submukosa oder Muskularis des Magens, Dünndarms oder Dickdarms gekennzeichnet; Oft ist die Ursache unbekannt. Auch das hypereosinophile Syndrom mit gastrointestinaler Beteiligung wird kurz beschrieben.
| Eosinophile Gastroenteritis und eosinophile Kolitis |
> Epidemiologie
Die Überprüfung einer US-amerikanischen bevölkerungsbasierten Datenbank mit mehr als 35 Millionen Kindern und Erwachsenen ergab eine Gesamtprävalenz der eosinophilen Gastroenteritis von 5,1/100.000 und der eosinophilen Kolitis von 2,1/100.000 Menschen. In anderen Studien war die Prävalenz jedoch fast doppelt so hoch. Die eosinophile Gastroenteritis tritt etwas häufiger bei Kindern auf, während die eosinophile Kolitis häufiger bei Erwachsenen auftritt.
Diese Störungen treten im dritten und vierten Lebensjahrzehnt auf. In den USA wurde eine höhere Prävalenz in den nördlichen Bundesstaaten festgestellt, und zwar in städtischen und vorstädtischen Gebieten häufiger als in ländlichen Gebieten. Auch bei Frauen und Weißen ist die Prävalenz etwas höher und die meisten Patienten mit eosinophiler Gastroenteritis verfügen über einen relativ hohen Bildungsgrad.
Es ist bemerkenswert, dass eosinophile Gastroenteritis und Kolitis mit allergischen Erkrankungen verbunden sind und Patienten häufig gleichzeitig an Arzneimittelallergien, Rhinitis, Asthma, Sinusitis, Dermatitis, Nahrungsmittelallergien, Ekzemen oder Urtikaria leiden.
Es ist erwiesen, dass es bei Patienten mit eosinophiler Gastroenteritis Fälle von autoimmunen Bindegewebserkrankungen gibt. Es gibt Berichte über 19 veröffentlichte Fälle, die einen Zusammenhang zwischen beiden zeigen.
| Bei 35 % dieser Patienten wurde ein Zusammenhang mit systemischem Lupus erythematodes, 20 % mit rheumatoider Arthritis, 15 % mit systemischer Sklerose und 15 % mit entzündlicher Myositis festgestellt. |
> Pathophysiologie
Die Pathogenese der Eosinophilie bei eosinophiler Gastroenteritis und Kolitis ist nur unzureichend untersucht. Die Histopathologie ist durch eine übermäßige Anzahl von Eosinophilen mit Anzeichen einer Degranulation gekennzeichnet.
Es ist bekannt, dass bei der eosinophilen Ösophagitis Nahrungsmittelallergene die Infiltration von Eosinophilen vorantreiben, da ihre Eliminierung aus der Nahrung eine wirksame Therapie darstellt; 74 % der Personen mit einer Diät, bei der 6 Lebensmittel eliminiert wurden, zeigten eine Verbesserung der Symptome und eine histologische Besserung.
Der Zusammenhang von Allergie und Atopie bei eosinophiler Gastroenteritis und eosinophiler Kolitis legt nahe, dass bei manchen Menschen auch andere Allergene dafür verantwortlich sein könnten, da die Hälfte der Patienten mit eosinophiler Gastritis bei Hautempfindlichkeitstests auf Nahrungsmittelallergene oder Aeroallergene positiv ausfielen. , mit einem Anstieg der Eosinophilenzahl im Blut.
Bei Patienten mit eosinophiler Gastroenteritis und erhöhter Expression von Genen, die an potenziellen operativen Signalwegen beteiligt sind, wurde ein Magentranskriptom beobachtet, einschließlich einer durch die Interleukine 4, 5 und 13 gesteuerten T-Helfer-Typ-Immunität.
Die Autoren halten es für wichtig, hervorzuheben, dass dieses Transkriptom zu mehr als 90 % mit der eosinophilen Ösophagitis korreliert, was darauf hindeutet, dass ähnliche Behandlungen für beide Erkrankungen wirksam sein könnten.
Einige Patienten mit eosinophilen Magen-Darm-Erkrankungen haben jedoch eine gemeinsame Autoimmunkomponente ohne Atopie, die über verschiedene immunologische Wege zu Eosinophilie führen könnte, was auf die Komplexität dieser Krankheit hinweist.
Auch eine gastrointestinale Dysbiose könnte bei der Pathophysiologie dieser Erkrankungen eine Rolle spielen. Veränderungen in der Darmmikrobiota wurden mit Allergien in Verbindung gebracht, es ist jedoch nicht bekannt, ob dies eine Ursache oder eine Folge der Krankheit ist.
Die Kombination aus genetischer Veranlagung, Dysbiose und Umwelt (z. B. aufgenommene oder inhalierte Allergene) bereitet wahrscheinlich die Voraussetzungen für Eosinophilie bei eosinophiler Kolitis und Gastroenteritis, es sind jedoch weitere Untersuchungen erforderlich, um die zugrunde liegende Pathogenese dieser Erkrankungen zu bestimmen. Komplex.
| Klinische Präsentation |
Patienten mit eosinophiler Gastroenteritis und eosinophiler Kolitis weisen in der Regel unspezifische gastrointestinale Symptome auf, wobei die Eosinophilenzahl im Blut normal sein kann.
Einige Studien berichten, dass die Mehrheit der Patienten (80 %) zumindest eine leichte periphere Eosinophilie aufweist.
Gastroenteritis und eosinophile Kolitis sind häufig mit ösophagealen Symptomen einer Refluxkrankheit, Dysphagie und anderen vagen Symptomen wie Bauchschmerzen, Übelkeit, Erbrechen, Gedeihstörung, Durchfall und Gewichtsverlust verbunden. Es wurden auch schwerwiegendere Erkrankungen beobachtet: Aszites, Volvulus, Invagination, Perforation und Obstruktion.
Das klinische Erscheinungsbild hängt wahrscheinlich von der Lokalisation sowie dem Ausmaß und der Tiefe der Erkrankung im Magen-Darm-Trakt ab. Bei Patienten mit einer stärkeren eosinophilen Beteiligung über die Schleimhaut hinaus in der Muscularis kann es zu einer Obstruktion kommen, während bei Patienten mit Serosa-Befall Aszites auftreten kann.
Obwohl bei Kindern mit eosinophiler Gastroenteritis eine ösophageale Eosinophilie und eine diagnostizierte eosinophile Ösophagitis beobachtet wurden, gibt es nur einen Fallbericht bei Erwachsenen. Von 30 Kindern mit eosinophiler Gastritis wurden 28 gleichzeitig einer Ösophagusbiopsie unterzogen. Zwölf (43 %) hatten gleichzeitig eine eosinophile Ösophagitis (≥15 Eosinophile/Hochleistungsfeld). Kein Patient hatte gleichzeitig eine eosinophile Kolitis, obwohl nur 7 (23 %) einer Dickdarmbiopsie unterzogen wurden.
| Diagnose |
Bei einer endoskopischen Untersuchung kann der Verdacht auf eine eosinophile Gastroenteritis und eine eosinophile Kolitis bestehen, und die Bildgebung kann bei der Beurteilung des Ausmaßes der Erkrankung hilfreich sein. Zur Bestätigung der Diagnose ist jedoch eine Biopsie erforderlich.
Endoskopie, Bildgebung und Histopathologie.
Bei Patienten mit eosinophiler Gastroenteritis können die endoskopischen Befunde normal erscheinen oder Folgendes aufweisen: Erythem, weiße Flecken, fokale Erosionen, Ulzerationen, Faltenverdickung, Polypen, Knötchen und Bröckeligkeit.
Bei 15 Patienten waren die endoskopischen Befunde weitgehend unspezifisch: Die meisten hatten ein Erythem, aber 2 Patienten hatten Geschwüre im Antrum duodeni.
Bei der eosinophilen Kolitis kann die Koloskopie Flecken von Schleimhautödemen, punktförmiges Erythem, erhabene weißliche Läsionen, blasse körnige Schleimhaut und aphthöse Ulzerationen aufdecken, obwohl diese Befunde selten und unzuverlässig sind.
In Bezug auf Bilder kann eine Schleimhautbeteiligung bei eosinophiler Gastroenteritis durch das Vorhandensein einer Verdickung der Falten, Polypen und Geschwüre in der Computertomographie (CT) nachgewiesen werden.
Bei der Erkrankung mit Beteiligung der Muskelschicht können verminderte Dehnbarkeit, Stenose und Faltenverdickung beobachtet werden. Bei Befall der Serosa kann es zu Aszites, Omentumverdickung und Lymphadenopathie kommen.
Bilder der eosinophilen Kolitis bei Erwachsenen und Kindern wurden nur in Fallberichten und Kleinserien beschrieben. Die Merkmale dieser Patienten sind das Vorhandensein des „Spinnenbein“-Zeichens, das durch eine diffuse Verdickung der Schleimhaut entsteht; Dieses Zeichen tritt auf, wenn der Kontrast im Längsschnitt des Darms im CT deutlich in die Nebenhöhlenschleimhaut eindringt. Bei einer Schleimhautbeteiligung wurde eine konzentrische Verdickung des Dickdarms und des Aszites beobachtet.
In der größten bisher veröffentlichten Serie von Kindern mit eosinophiler Kolitis und radiologischen Befunden wurde bei 6 von 7 Patienten ein abnormaler Dickdarm mit parietaler, australer (isoliert) und umlaufender Verdickung festgestellt.
Die Histologie gastrointestinaler Schleimhautbiopsien ist der Goldstandard für die Diagnose von eosinophiler Gastroenteritis und eosinophiler Kolitis. Das wichtigste diagnostische Kriterium ist eine übermäßige Schleimhauteosinophilie ohne bekannte Ursache.
Allerdings ist die Anzahl der für eine Diagnose erforderlichen Eosinophilen nicht so genau definiert wie bei der eosinophilen Ösophagitis (15 Eosinophile/Hochleistungsfeld).
In einer kürzlich durchgeführten Untersuchung wurden 30 Eosinophile/Hochleistungsfelder als angemessen erachtet, um die Diagnose einer eosinophilen Gastritis zu stellen, während >50 Eosinophile/Hochleistungsfelder im rechten Dickdarm für die Diagnose einer eosinophilen Kolitis vorgeschlagen wurden, > 35 Eosinophile/Hochleistungsfeld im Querkolon oder 25/Hochleistungsfeld im linken Dickdarm. (Tisch).
Für die Diagnose wurden neben anderen histologischen Merkmalen auch höhere Werte vorgeschlagen, es handelt sich dabei jedoch lediglich um Vorschläge, die aus Fallserien abgeleitet wurden und bisher nicht in verschiedenen Populationen validiert wurden, wie dies bei der eosinophilen Ösophagitis der Fall ist. Derzeit gibt es keine formellen Leitlinien für die Diagnose einer Schleimhautbiopsie.
Es ist zu bedenken, dass Eosinophile normale Bestandteile des Darms sind und dass ihre Anzahl je nach Region, Klima, Alter, Exposition gegenüber Nahrungsmittelallergenen und Infektionserregern stark variieren kann.
Bei der Auswertung von Biopsieproben müssen diese Faktoren berücksichtigt werden. Diese Faktoren können Zweifel an der Diagnose aufkommen lassen, was bedeutet, dass es Fälle gibt, die unbemerkt bleiben könnten, wenn bei allen Biopsien nicht routinemäßig Eosinophile gezählt werden.
Die eosinophile Gastroenteritis wurde ursprünglich 1970 nach der Infiltrationsstelle der Eosinophilen klassifiziert: mukosal, muskulös oder serös.
Eine 1990 durchgeführte Studie an 40 Patienten mit eosinophiler Gastroenteritis zeigte, dass 23 von ihnen eine Schleimhauterkrankung hatten, bei 12 war die Muskelschicht betroffen und bei 5 war die Subserosaschicht betroffen. Eine anschließende Untersuchung zeigte deutlich, dass eine Verlagerung von der Muskularis- zur Schleimhautbeteiligung stattgefunden hatte.
In dieser Studie hatten 52 Patienten eine Schleimhauterkrankung, 3 eine Muskelschichterkrankung und 4 eine subseröse Erkrankung. Obwohl diese Änderung ein endoskopisches Diagnosekriterium sein könnte, ist es wahrscheinlich, dass Fälle jetzt früher als in der ursprünglichen Serie diagnostiziert werden können, indem eine Biopsie der oberflächlichen Schleimhaut anstelle der herkömmlichen Biopsie in voller Dicke durchgeführt wird, was zu einer Verringerung des Fortschreitens führt. von der Muskel- zur Serosaschicht, sekundär zu einer wirksamen Behandlung, im Vergleich zu früheren Berichten.
Die Histopathologie der Schleimhaut bei ursprünglicher Gastroenteritis und eosinophiler Kolitis ist ähnlich und wird als überschüssige Eosinophile in der Lamina propria mit Degranulation und möglicher Infiltration des oberflächlichen Epithels und der Krypten mit Bildung von oberflächlichen Abszessen und Krypta-Abszessen beschrieben.
Das Epithel kann degenerative und regenerative Veränderungen mit foveolärer und kryptischer Hyperplasie aufweisen. Häufig wird ein erheblicher Überschuss an blatt- oder gruppenförmig angeordneten Eosinophilen beobachtet.
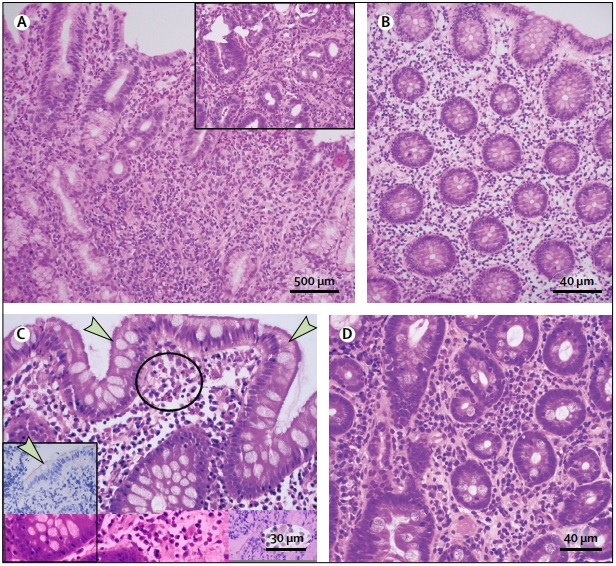
(A) Eosinophile Gastritis mit Schichten von >30 Eosinophilen pro Hochleistungsfeld (HPF) in der Lamina propria, gruppiert um Drüsen (Einschub). (B) Eosinophile Kolitis, Biopsie aus dem linken Dickdarm, mit > 35 Eosinophilen pro HPF in der Lamina propria. (C) Kolon-Spirochetose, ein blauer Schleier auf der Hämatoxylin- und Eosin-Färbung, der an der Oberfläche des Dickdarmepithels haftet (angezeigt durch Pfeile), mit Ansammlungen von Eosinophilen in der Lamina propria (Kreis); Der Einschub zeigt die Immunhistochemie zur Identifizierung von Oberflächenspirochäten (angezeigt durch den Pfeil). (D) Zwölffingerdarm-Eosinophilie bei einem Patienten mit funktioneller Dyspepsie vom postprandialen Distress-Typ mit 36 Eosinophilen pro 5 HPF in der Lamina propria
Eine durch Immunhistochemie nachgewiesene starke Ablagerung von extrazellulärem Hauptgrundprotein des Eosinophilen-Granulats weist auf eine Degranulation der Eosinophilen hin und wurde bei Patienten mit eosinophiler Gastroenteritis häufiger beobachtet als bei gesunden Kontrollpersonen.
Degranulation kann die Anzahl der Eosinophilen verschleiern, wie dies bei der eosinophilen Ösophagitis der Fall ist, bei der die Anzahl der im Plattenepithel gefundenen Eosinophilen bei Verwendung der Immunfärbung mit Hauptproteinen signifikant höher war als bei Hämatoxylin-Eosin .
> Biopsiestellen für eosinophile Gastroenteritis
Die Wahl der Stellen für die endoskopische Darmbiopsie ist wichtig, wenn die Diagnose unsicher ist, insbesondere bei eosinophiler Gastroenteritis und eosinophiler Kolitis. Die Pathologie kann unregelmäßig sein. Um die Diagnose zu bestätigen, ist es daher ratsam, Biopsieproben aus allen Bereichen des Darms zu entnehmen, einschließlich offensichtlicher makroskopischer Läsionen.
Eine bewährte Vorgehensweise besteht darin, sich für empfohlene Biopsiestellen des Magenkörpers, des Antrums und der Incisura auf das Sydney- System zu verlassen. Die Autoren empfehlen, mindestens 4 Biopsieproben aus dem ersten und zweiten Teil des Zwölffingerdarms zu entnehmen, wie sie für die Diagnose einer Zöliakie bei fleckiger Erkrankung angewendet werden, und die Proben in getrennten Behältern aufzubewahren.
Bei Verdacht auf eine eosinophile Gastroenteritis bei pädiatrischen Patienten wird außerdem empfohlen, Biopsien der Speiseröhre, des Magenkörpers, der Antrumschleimhaut und des Zwölffingerdarms durchzuführen.
Für die Diagnose einer eosinophilen Kolitis, die nicht mit makroskopisch sichtbaren Läsionen einhergeht, können sowohl bei Erwachsenen als auch bei Kindern dieselben Kriterien wie bei entzündlichen Darmerkrankungen angewendet werden, wobei die optimale Leistung erzielt wird, wenn Proben an mehreren Stellen entnommen werden, was zu einer höheren Präzision führt. Diagnose und bessere diagnostische Übereinstimmung zwischen Beobachtern.
Daher empfehlen die Autoren in diesen Fällen, zufällige Biopsieproben aus dem terminalen Ileum und jedem Dickdarmsegment (vom Blinddarm bis zum Rektum) zu entnehmen und die Proben in separate Behälter zu geben.
> Differentialdiagnosen
Obwohl gezeigt wurde, dass eosinophile Gastroenteritis und Kolitis mit anderen Krankheiten, insbesondere Allergien , verbunden sind , ist die genaue Pathogenese unbekannt.
Daher werden diese Krankheiten durch Ausschluss diagnostiziert, da bei vielen Erkrankungen, die eine klinisch-pathologische Untersuchung erfordern, eine übermäßige Anzahl von Eosinophilen im Darm beobachtet werden kann. Liegt eine Eosinophilie vor, besteht der Verdacht auf eine Infektion.
Die bekanntesten Infektionen, die Eosinophilie auslösen, sind parasitärer Natur. Eine Reiseanamnese und eine parasitologische Untersuchung des Stuhls auf Eier und Parasiten sind empfehlenswert, wenn die Biopsie eine Eosinophilie zeigt. Jüngste Berichte über Patienten mit Kolon-Spirochetose im Zusammenhang mit einem Reizdarmsyndrom ohne Verstopfung zeigten bei der Kolonbiopsie eine charakteristische Eosinophilie mit benachbarten Spirochätenansammlungen im oberflächlichen Kolonepithel.
Es wurde festgestellt, dass 2,3 % der Gesamtbevölkerung, die sich einer Koloskopie unterzogen, an einer eosinophilen Kolon-Spirochetose litten . Die Anzahl war bei Patienten mit Kolon-Spirochetose höher als bei Patienten ohne Spirochetose, selbst im Rektum.
Personen mit Kolon-Spirochetose leiden häufiger an einem entzündlichen Darmsyndrom als Personen ohne Kolon-Spirochetose. Bei 62 % der Patienten trat Durchfall auf, im Vergleich zu 31 % der Kontrollen, und bei 52 % der Patienten traten Bauchschmerzen auf, im Vergleich zu 17 % der Kontrollen.
Magen-Eosinophilie kann sowohl vor als auch nach einer Eradikationsbehandlung mit einer Helicobacter-pylori- Infektion verbunden sein. Auch eine Arzneimittelüberempfindlichkeit kann eine Eosinophilie auslösen; zum Beispiel Mycophenolat und nichtsteroidale entzündungshemmende Medikamente. Da diese jedoch häufig verwendet werden, sollten sie immer im Rahmen der Differenzialdiagnose berücksichtigt werden.
Bei Nahrungsmittelüberempfindlichkeit wie auch bei allergischer Proktokolitis gibt es bei allen gesunden Babys eine unterschiedliche Prävalenz mit einer unerwünschten Reaktion auf Kuhmilchprotein, die zwischen 0,3 % und 7,5 % liegt. In einer prospektiven Studie hatten 14 von 22 Säuglingen (64 %) mit rektaler Blutung eine allergische Kolitis (definiert durch die Anzahl oder Lage der Eosinophilen), 5 (23 %) hatten normale Biopsien und 3 (13 %) hatten eine unspezifische Kolitis.
Rektale Blutungen verschwanden bei allen Säuglingen mit normalen Biopsien oder unspezifischer Kolitis ohne Ernährungsumstellung, mit Ausnahme eines Säuglings, bei dem später eine entzündliche Darmerkrankung im Kindesalter diagnostiziert wurde.
Biopsien der Rektumschleimhaut bei allergischer Proktokolitis zeichnen sich durch einen Anstieg der Anzahl eosinophiler Granulozyten in der Lamina propria, dem oberflächlichen Epithel und den Krypten sowie der Muscularis-Schleimhaut ohne nennenswerte architektonische Veränderungen aus.
Typischerweise wird diese Diagnose klinisch gestellt und die Symptome klingen 2 bis 3 Tage nach der Entfernung des Kuhmilchproteins ab. Dickdarmbiopsien von Patienten mit Nahrungsmittelallergien (eine große Auswahl an Nahrungsmitteln) zeigen eine erhöhte Anzahl von Eosinophilen im Dickdarm mit Degranulation.
Bei aktiver Zöliakie wurde ein Anstieg der duodenalen Eosinophilen beschrieben. In jüngerer Zeit wurde bei 150 Patienten mit Zöliakie eine deutliche Infiltration von Eosinophilen (bis zu 50 Eosinophile/Hochleistungsfeld) nachgewiesen. Es wurde vermutet, dass Eosinophile an Schleimhautschäden beteiligt sind, da sie in den fortgeschrittensten histologischen Stadien gefunden wurden.
Gastrointestinale Biopsien bei Patienten mit entzündlichen Darmerkrankungen zeigen Eosinophile in unterschiedlicher Anzahl. Wenn Eosinophile in Magenbiopsien gefunden werden, sollte eine entzündliche Darmerkrankung vermutet werden, da Dickdarmbiopsien bei Patienten mit Morbus Crohn oder Colitis ulcerosa im Vergleich zu Kontrollen auch eine größere Anzahl von Eosinophilen in der Lamina propria zeigen.
Eine eosinophile Infiltration des Magen-Darm-Trakts wurde auch bei Bindegewebserkrankungen wie rheumatoider Arthritis, systemischer Sklerose, Vaskulitis und eosinophiler Granulomatose mit Polyangiitis beobachtet.
| Funktionelle Dyspepsie und duodenale Eosinophilie |
Eosinophilie wurde in Duodenalbiopsien von Patienten mit funktioneller Dyspepsie beschrieben, insbesondere bei Patienten mit frühem Sättigungsgefühl, obwohl die Anzahl der Eosinophilen geringer ist als die, die bei eosinophiler Gastroenteritis beobachtet wird.
In einer schwedischen Studie hatte funktionelle Dyspepsie bei Personen mit erhöhten Eosinophilenzahlen in D1 (Zwölffingerdarm) (>22 Eosinophile/5 Hochleistungsfelder) ein Odds Ratio von 11,7.
Eosinophilie an Tag 1 war signifikant mit frühem Sättigungsgefühl assoziiert, was eine duodenale Eosinophilie mit dem Einsetzen von postprandialem Stress, einem Subtyp der funktionellen Dyspepsie, mit 52 Eosinophilen/5 Hochleistungsfeldern im Vergleich zu 34 Eosinophilen/5 Hochleistungsfeldern bei den Kontrollen impliziert. In Ex-vivo-Biopsien von Patienten mit funktioneller Dyspepsie wurde gezeigt, dass eine gestörte Darmbarriere und eine beeinträchtigte neuronale Funktion mit einer duodenalen Eosinophilie einhergehen.
In Ex-vivo-Biopsien von Patienten mit funktioneller Dyspepsie wurde außerdem ein Anstieg der Zwölffingerdarmpermeabilität (gemessen am transepithelialen elektrischen Widerstand) und der parazellulären Permeabilität im gesamten Zwölffingerdarm mit Eosinophilie und Mastzellinfiltration festgestellt.
Bei diesen Patienten war die neuronale Signalübertragung, gemessen anhand der Kalziumreaktionen auf elektrische und chemische Depolarisation, im submukosalen Plexus verändert, wobei eine signifikante negative Korrelation zwischen der Kalziumreaktion auf elektrische Stimulation und der Anzahl der Eosinophilen bestand.
Es ist möglich, dass diese Beobachtungen einen organischen Mechanismus der Störung bei Patienten mit funktioneller Dyspepsie widerspiegeln, bei dem ein Allergen oder eine Infektion die Unterbrechung der Barriere und die Erzeugung einer Immunantwort vom Typ T-Helfer 2 verursacht, die die Rekrutierung von Eosinophilen induziert Degranulation, die wiederum das submuköse Nervensystem und die gastroduodenale Funktion beeinträchtigt. Bei funktioneller Dyspepsie wurde keine periphere Eosinophilie beobachtet.
| Hypereosinophiles Syndrom mit gastrointestinaler Beteiligung |
Derzeit wird das hypereosinophile Syndrom durch eine absolute Eosinophilenzahl im Blut von >1.500 Zellen/μl über mehr als einen Monat definiert (obwohl bei schweren Endorganschäden die Diagnose sofort gestellt werden kann, um Verzögerungen bei der Therapie zu vermeiden). .
Es kann auch eine Gewebehypereosinophilie mit Anzeichen einer Eosinophilen-vermittelten Zielorganschädigung beobachtet werden, allerdings müssen alle bekannten Ursachen einer Hypereosinophilie ausgeschlossen werden, bevor die Diagnose eines hypereosinophilen Syndroms gestellt werden kann.
Zu den sekundären Ursachen der Blut-Eosinophilie gehören: parasitäre oder virale Infektionen, allergische Erkrankungen, Medikamente und Chemikalien, Hypoadrenalismus und Krebs. Das hypereosinophile Syndrom ist durch eine Multiorganinfiltration von Eosinophilen gekennzeichnet, im Gegensatz zur Beteiligung einzelner Organe, wie sie bei eosinophilen Magen-Darm-Erkrankungen auftritt.
Es wurde vorgeschlagen, dass der Begriff hypereosinophiles Überlappungssyndrom verwendet werden kann , wenn eosinophile gastrointestinale Störungen gleichzeitig mit Bluthypereosinophilie bestehen und nur ein Organ betroffen ist . Zu den Organbeteiligungen bei diesem Syndrom können das chronische Budd-Chiari-Syndrom, aktive Hepatitis, eosinophile Cholangitis, eosinophile Gastroenteritis und eosinophile Kolitis gehören, nicht jedoch die eosinophile Ösophagitis.
Bemerkenswert ist, dass sich die systemische Mastzellstörung, die systemische Mastozytose, auch mit intestinaler Eosinophilie manifestieren kann, die durch die lokalisierte Freisetzung eosinophiler chemotaktischer Mediatoren stimuliert wird.
| Behandlung von eosinophiler Gastroenteritis und eosinophiler Kolitis |
Sekundäre Ursachen wie Medikamente oder parasitäre Infektionen müssen sorgfältig abgeklärt und behandelt werden. Liegt ein Mikronährstoffmangel vor, muss dieser ebenfalls behoben werden. Die Spirochetose des Dickdarms, die mit einer Eosinophilie des Dickdarms und gastrointestinalen Symptomen einhergeht, kann mit Metronidazol behandelt werden .
Es wurde gezeigt, dass diese Behandlung die Magen-Darm-Symptome verbessert, obwohl randomisierte Studien fehlen. Zu den Therapien, die eine gewisse Wirksamkeit bei der Behandlung der funktionellen Dyspepsie mit duodenaler Eosinophilie haben, gehören außerdem die Leukotrienrezeptorantagonisten Montelukast und Protonenpumpenhemmer (möglicherweise aufgrund der Botain-Hemmung).
Es konnte jedoch nicht nachgewiesen werden, dass diese oder andere Therapien zu einer Verbesserung der Symptome der funktionellen Dyspepsie durch Stabilisierung oder Verringerung der Anzahl eosinophiler Granulozyten führen.
Wenn keine sekundäre Ursache für Eosinophilie gefunden wird, kann die Diagnose einer eosinophilen Gastroenteritis oder eosinophilen Kolitis gestellt werden, wobei mehrere Therapieoptionen zur Verfügung stehen, obwohl die Evidenz für die meisten Therapien auf Fallberichte und kleine unkontrollierte Fallserien beschränkt ist.
| Diättherapie |
Als Erstbehandlung bei eosinophilen Magen-Darm-Erkrankungen wird eine diätetische Therapie empfohlen.
Empirische Diäten zur Eliminierung von Nahrungsmitteln, die häufig beteiligte Nahrungsantigene (Milch, Weizen, Soja, Eier, Nüsse und Schalentiere) ausschließen, haben sich bei der Behandlung der eosinophilen Ösophagitis als wirksam erwiesen, was darauf hindeutet, dass Nahrungsmittel ein wichtiger antigener Auslöser bei prototypischer Eosinophilie sind Krankheit.
Verschiedene Diäten zur Nahrungseliminierung scheinen bei der eosinophilen Gastroenteritis wirksam zu sein; Allerdings beschränken sich die Belege auf Fallberichte und kleine Kasuistiken. Dabei zeigte eine der größten Studien, eine retrospektive Fallserie von 17 Kindern mit eosinophiler Gastroenteritis, eine klinische Ansprechrate auf diese Diät von 82 %.
Obwohl in einigen Fallberichten erfolgreiche Ergebnisse bei der Eliminierung bestimmter Nahrungsmittel auf der Grundlage von Allergietests beschrieben werden, wurde berichtet, dass das Ansprechen auf die Behandlung bei Nahrungsmittelallergien, die durch Hautempfindlichkeitstests oder Messung der Serum-IgE-Konzentrationen festgestellt wurden, fehlschlug. spezifisch für Lebensmittel, was darauf hindeutet, dass die selektive Eliminierung von Lebensmitteln möglicherweise nicht wirksam ist.
Tatsächlich werden spezifische Lebensmittelallergietests derzeit nicht zur Behandlung der eosinophilen Gastroenteritis empfohlen.
75 % der Säuglinge, denen eine strikte, ausschließende Elementardiät verabreicht wurde, zeigten auch die Wirksamkeit dieser Diät bei der Behandlung von eosinophiler Gastroenteritis und eosinophiler Kolitis; Allerdings dürfte die Compliance bei älteren Kindern und Erwachsenen ihren Nutzen erheblich einschränken.
| Kortikosteroide |
Kortikosteroide werden als pharmakologische Erstbehandlung bei eosinophiler Gastroenteritis und eosinophiler Kolitis eingesetzt, wenn die diätetische Therapie kein ausreichendes klinisches Ansprechen erzielt hat. Es hat sich gezeigt, dass orales Prednison 20–40 mg/Tag über 2 Wochen bei den meisten Patienten eine klinische Remission induziert, obwohl in einigen Berichten höhere Dosen (0,5–1 mg/kg) empfohlen werden.
Patienten, deren Symptome während oder nach dem Ausschleichen des Arzneimittels wieder auftreten, benötigen möglicherweise eine Fortsetzung der Erhaltungstherapie. Systemische Kortikosteroide wie Prednison werden oft in niedrigen Dosen (5–10 mg/Tag oder die zur Aufrechterhaltung der Reaktion erforderliche Mindestdosis) eingesetzt.
Aufgrund der unerwünschten Langzeitnebenwirkungen einer systemischen Kortikosteroidtherapie können jedoch andere alternative Wirkstoffe in Betracht gezogen werden, die weniger wahrscheinlich in den systemischen Kreislauf gelangen. Mit der Anwendung von Budesonid (3-9 mg/Tag) wurde ein gutes Ansprechen erzielt; Es wurde gezeigt, dass orales Fluticason die gleichzeitige Eosinophilie des Magens bei Kindern mit eosinophiler Ösophagitis verringert.
| Steroidsparende Wirkstoffe |
Bei Personen, die eine Erhaltungstherapie mit Kortikosteroiden benötigen oder nicht ausreichend auf deren Wirkung ansprechen, wurden mehrere Wirkstoffe mit positiven Ergebnissen eingesetzt. Einige dieser Wirkstoffe werden zur Behandlung von entzündlichen Darmerkrankungen eingesetzt, beispielsweise Mesalazin (oder 5-Aminosalicylsäure), Azathioprin und Anti-TNF-Wirkstoffe wie Infliximab und Adalimumab.
Weitere Optionen sind Mastzellstabilisatoren wie Natriumcromoglycat und Ketotifen sowie der Leukotrienrezeptor-Antagonist Montelukast und Omalizumab, ein Anti-IgE-Mittel, das nachweislich die Symptome deutlich verbessert und die Zahl senkt. von gastroduodenalen Eosinophilen bei 9 Personen mit eosinophiler Gastroenteritis.
Es wurde festgestellt, dass der Interleukin-5-Blocker Mepolizumab bei einer Gruppe von 6 Patienten mit eosinophiler Gastroenteritis oder hypereosinophilem Syndrom eine Reaktion hervorrief; Allerdings wurde bei allen Respondern eine Rebound-Eosinophilie mit einem damit verbundenen klinischen Rückfall beobachtet.
Ein neuer Antikörper gegen CCR3, einen Eotaxin-Rezeptor, der von Eosinophilen exprimiert wird und deren Rekrutierung an Entzündungsherden erleichtert, hat in einem Mausmodell der eosinophilen Gastroenteritis gezeigt, dass er eosinophile Entzündungen und Durchfall verringert.
| Transplantation fäkaler Mikrobiota |
Die Transplantation fäkaler Mikrobiota hat sich bei der Behandlung von entzündlichen Darmerkrankungen, einschließlich refraktärer Clostridium-difficile- Infektion und Colitis ulcerosa, als wirksam erwiesen.
Diese Behandlung wurde erfolgreich bei einem Patienten mit eosinophiler Enterokolitis im Ileum und Dickdarm eingesetzt, dessen Erkrankung auf enterale Ernährung, Azathioprin, Steroide und chirurgische Resektion resistent war, aber auf eine fäkale Mikrobiota-Transplantation von einem einzelnen Spender ansprach. , zusätzlich zu oralen Kortikosteroiden.
| Operation |
Bei den Patienten können Komplikationen einer Darmentzündung auftreten, einschließlich Strikturen oder Perforationen, und eine chirurgische Therapie erforderlich sein. Sie können zufällig in einer chirurgisch resezierten Probe diagnostiziert werden.
Aber auch bei akutem Abdomen, bekannter (oder stark vermuteter) eosinophiler Gastroenteritis oder eosinophiler Kolitis können die Symptome auf eine konservative Behandlung mit Immunsuppressiva ansprechen.
| Hypereosinophiles Syndrom mit gastrointestinaler Beteiligung |
Die Behandlung des hypereosinophilen Syndroms unterscheidet sich von der Behandlung der eosinophilen Gastroenteritis und Kolitis. Kortikosteroide, Tyrosinkinaseinhibitoren wie Imatinib, Hydroxyharnstoff, Interferon-α und Anti-Interleukin 5,1 sind wirksam zur Behandlung des hypereosinophilen Syndroms. Bei einer Strongyloides-Infektion wird das Antiparasitikum Ivermectin empfohlen .
| Klinischer Verlauf der eosinophilen Gastroenteritis und eosinophilen Kolitis |
Der klinische Verlauf dieser Erkrankungen wurde anhand einer Nachuntersuchung von 43 Patienten beschrieben, von denen die meisten eine spontane Remission zeigten oder auf die Erstlinientherapie ansprachen. Über eine mittlere Nachbeobachtungszeit von 13 Jahren erlitten 42 % dieser Patienten keine Rückfälle, 37 % zeigten einen Verlauf von Rückfällen und Remissionen und die restlichen 21 % hatten eine chronische Erkrankung ohne Remission.
Die Nachbeobachtung von mehr als einem Jahr Studienpatienten mit eosinophiler Kolitis zeigte, dass 5 (45 %) nach Absetzen der Steroide Rückfälle erlitten (13 Episoden); 2 von ihnen benötigten eine langfristige Erhaltungstherapie mit Prednison; Bei einem Patienten war aufgrund einer Perforation eine Ileumresektion erforderlich.
Obwohl es nur zwei kleine Studien gab, deuten die Daten darauf hin, dass Patienten, die auf eine anfängliche Diät oder Kortikosteroide ansprechen, langfristig überwacht werden sollten. Bei Patienten, die während der Reduzierung oder Beendigung der Kortikosteroidtherapie einen Rückfall erleiden, kann die Kortikosteroidtherapie erhöht oder neu begonnen werden, mit dem Ziel, auf ein Kortikosteroid mit geringerer Bioverfügbarkeit oder ein steroidsparendes Mittel umzusteigen.
| Schlussfolgerungen und zukünftige Richtungen. |
Derzeit kann Eosinophilie im gesamten Darmtrakt als primäre eosinophile Magen-Darm-Erkrankung (eosinophile Gastroenteritis oder eosinophile Kolitis) oder als Folge einer als parasitäre Infektion bekannten Ursache erkannt werden.
Es wurden auch neue eosinophile Darmerkrankungen erkannt, wie z. B. duodenale Eosinophilie bei funktioneller Dyspepsie und Kolon-Spirochetose mit einer größeren Anzahl von Kolon-Eosinophilen.
Daher ist ein durchdachter klinisch-pathologischer Ansatz erforderlich, um sicherzustellen, dass eine korrekte Diagnose und eine gezielte Behandlung erfolgen. Weitere Fallkontroll- und Kohortenstudien sind erforderlich, um die ätiologischen Faktoren und den natürlichen Verlauf der Krankheit besser zu charakterisieren.
Um eine sichere und wirksame Therapie für Patienten bereitzustellen, die eine langfristige Erhaltungstherapie benötigen, sind außerdem strenge therapeutische Studien zur Untersuchung steroidsparender Wirkstoffe erforderlich.
Es besteht die Hoffnung, dass mit fortschreitender Forschung die Ursache (oder Ursachen) primärer eosinophiler Magen-Darm-Erkrankungen ermittelt werden können, was die erfolgreiche Ausrichtung von Erstlinientherapien für diese Störungen anstelle eines Versuch-und-Irrtum-Ansatzes ermöglicht. was gängige Praxis darstellt.















