Einführung
Die Coronavirus-Krankheit 2019 (Covid-19), die durch das schwere akute respiratorische Syndrom Coronavirus 2 (SARS-CoV-2) verursachte Krankheit, wurde erstmals im Dezember 2019 identifiziert und entwickelte sich schnell zu einer globalen Pandemie.
Ältere Menschen und Menschen mit Begleiterkrankungen wie Fettleibigkeit, Herz-Kreislauf-Erkrankungen und Diabetes mellitus haben ein höheres Risiko, ins Krankenhaus eingeliefert zu werden oder an Covid-19 zu sterben. Einige Behandlungen wie monoklonale Antikörper verringern das Risiko einer Progression von Covid-19. Zusätzliche Therapieoptionen könnten den Patienten zugute kommen und die Gesundheitssysteme entlasten.
Remdesivir ist ein direkt wirkender Nukleotid-Prodrug-Inhibitor der RNA-abhängigen RNA-Polymerase von SARS-CoV-2; hat eine starke nanomolare Aktivität in primären Epithelzellen der menschlichen Atemwege. Eine Phase-3-Studie mit Remdesivir zeigte, dass sowohl eine 10-tägige als auch eine 5-tägige Kur mit Remdesivir die Genesungszeit bei hospitalisierten Covid-19-Patienten verkürzte.
Eine frühzeitige Behandlung anderer akuter Virusinfektionen verbessert die klinischen Ergebnisse und verringert die Mortalität. Diese Strategie wurde auch für Covid-19 vorgeschlagen. Wir stellten die Hypothese auf, dass ein früherer Beginn einer kurzen Remdesivir-Behandlung im ambulanten Bereich die Krankenhauseinweisungen und die Sterblichkeit verringern würde.
Hier berichten wir über die Ergebnisse einer doppelblinden, randomisierten, placebokontrollierten Studie, in der die Wirksamkeit und Sicherheit einer dreitägigen Remdesivir-Behandlung bei nicht hospitalisierten Hochrisikopatienten mit Covid-19 untersucht wurde.
Hintergrund
Remdesivir verbessert die klinischen Ergebnisse bei Krankenhauspatienten mit mittelschwerer bis schwerer Coronavirus-Erkrankung 2019 (Covid-19). Es ist nicht bekannt, ob die Anwendung von Remdesivir bei symptomatischen, nicht hospitalisierten Patienten mit Covid-19, bei denen ein hohes Risiko für eine Krankheitsprogression besteht, einen Krankenhausaufenthalt verhindert.
Methoden
Wir führten eine randomisierte, doppelblinde, placebokontrollierte Studie mit nicht hospitalisierten Patienten mit Covid-19 durch, bei denen die Symptome in den letzten 7 Tagen auftraten und die mindestens einen Risikofaktor für das Fortschreiten der Krankheit aufwiesen (Alter ≥ 60 Jahre, Fettleibigkeit usw.). bestimmte gleichzeitig bestehende Erkrankungen).
Die Patienten wurden nach dem Zufallsprinzip einer intravenösen Gabe von Remdesivir (200 mg am Tag 1 und 100 mg an den Tagen 2 und 3) oder Placebo zugeteilt.
Der primäre Wirksamkeitsendpunkt war eine Kombination aus Krankenhausaufenthalt oder Tod aufgrund einer COVID-19-bedingten Ursache am 28. Tag. Der primäre Sicherheitsendpunkt war jedes unerwünschte Ereignis. Ein sekundärer Endpunkt war eine Kombination aus einem Arztbesuch im Zusammenhang mit Covid-19 oder einem Tod jeglicher Ursache bis zum 28. Tag.
Ergebnisse
In die Analysen wurden insgesamt 562 Patienten einbezogen, die randomisiert wurden und mindestens eine Dosis Remdesivir oder Placebo erhielten: 279 Patienten in der Remdesivir-Gruppe und 283 in der Placebo-Gruppe.
Das Durchschnittsalter betrug 50 Jahre, 47,9 % der Patienten waren Frauen und 41,8 % waren Hispanoamerikaner oder Latinos. Die häufigsten Begleiterkrankungen waren Diabetes mellitus (61,6 %), Fettleibigkeit (55,2 %) und Bluthochdruck (47,7 %).
COVID-19-bedingte Krankenhausaufenthalte oder Todesfälle jeglicher Ursache traten bei 2 Patienten (0,7 %) in der Remdesivir-Gruppe und 15 (5,3 %) in der Placebo-Gruppe auf (Hazard Ratio 0,13; 95 %-Konfidenzintervall [KI] 0,03 bis 0,59). ; P=0,008).
Insgesamt 4 von 246 Patienten (1,6 %) in der Remdesivir-Gruppe und 21 von 252 (8,3 %) in der Placebo-Gruppe hatten am 28. Tag einen Arztbesuch im Zusammenhang mit Covid-19 (Risikoverhältnis 0,19; 95 %-KI 0,07). bis 0,56).
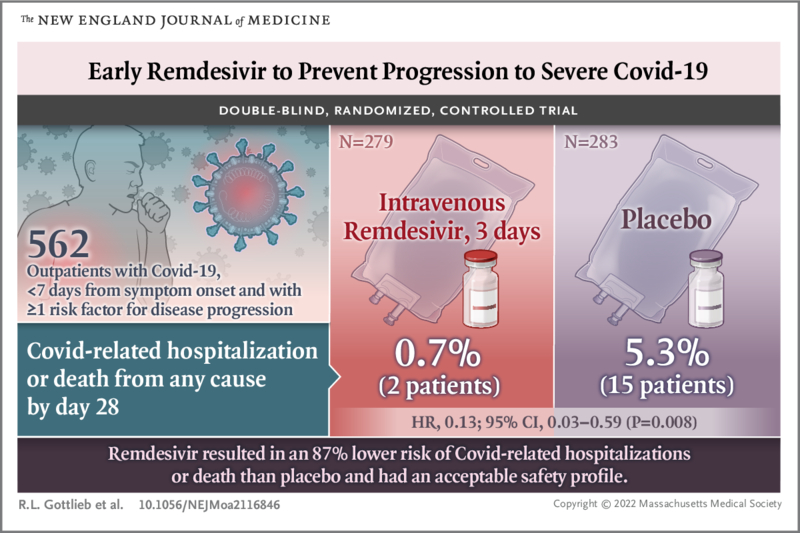
Schlussfolgerungen Bei nicht hospitalisierten Patienten, bei denen ein hohes Risiko einer Covid-19-Progression bestand, hatte eine dreitägige Behandlung mit Remdesivir ein akzeptables Sicherheitsprofil und führte zu einem um 87 % geringeren Risiko für einen Krankenhausaufenthalt oder Tod als Placebo. |
(Gefördert von Gilead Sciences; PINETREE ClinicalTrials.gov-Nummer, NCT04501952. öffnet in neuem Tab; EudraCT-Nummer, 2020-003510-12. öffnet in neuem Tab.)