Zusammenfassung Eine beeinträchtigte Riechfunktion ist ein häufiges Symptom von COVID-19, ihre Ätiologie ist jedoch unbekannt. Eine zentrale Frage ist, ob SARS-CoV-2 (CoV-2), der Erreger von COVID-19, den Geruchssinn direkt beeinflusst, indem es olfaktorische sensorische Neuronen oder ihre Ziele im Riechkolben infiziert, oder indirekt, durch Störung unterstützender Zellen. Hier identifizieren wir Zelltypen im Riechepithel und Riechkolben, die SARS-CoV-2-Zelleintrittsmoleküle exprimieren. Umfangreiche Sequenzierungen zeigten, dass die Riechschleimhaut von Mäusen, nichtmenschlichen Primaten und Menschen zwei Schlüsselgene exprimiert, die am Eintritt von CoV-2 beteiligt sind: ACE2 und TMPRSS2. Die Einzelzellsequenzierung ergab jedoch, dass ACE2 eher in Stützzellen, Stammzellen und perivaskulären Zellen als in Neuronen exprimiert wird. Die Immunfärbung bestätigte diese Ergebnisse und zeigte eine weit verbreitete Expression des ACE2-Proteins in den dorsal gelegenen olfaktorischen Epithelzellen und in den Perizyten des Riechkolbens der Maus. Diese Ergebnisse legen nahe, dass eine CoV-2-Infektion nicht-neuronaler Zelltypen bei COVID-19-Patienten zu Anosmie und damit verbundenen Veränderungen der Geruchswahrnehmung führt. |
Wie COVID-19 zu Geruchsverlust führt Harvard Medical School. Von Kevin Jiang
Vorübergehender Geruchsverlust oder Anosmie ist das wichtigste neurologische Symptom und einer der frühesten und am häufigsten gemeldeten Indikatoren für COVID-19. Studien deuten darauf hin, dass es ein besserer Krankheitsindikator ist als andere bekannte Symptome wie Fieber und Husten, aber die zugrunde liegenden Mechanismen des Geruchsverlusts bei COVID-19-Patienten sind unklar.
Jetzt hat ein internationales Forscherteam unter der Leitung von Neurowissenschaftlern der Harvard Medical School die Arten von Riechzellen in der oberen Nasenhöhle identifiziert, die am anfälligsten für eine Infektion durch SARS-CoV-2 sind, das Virus, das COVID-19 verursacht.
Überraschenderweise gehören die sensorischen Neuronen, die den Geruchssinn erkennen und an das Gehirn weiterleiten, nicht zu den gefährdeten Zelltypen.
In einem in Science Advances veröffentlichten Bericht stellte das Forschungsteam fest, dass olfaktorische sensorische Neuronen nicht das Gen exprimieren , das für das ACE2-Rezeptorprotein kodiert, das SARS-CoV-2 verwendet, um in menschliche Zellen einzudringen. Stattdessen wird ACE2 in Zellen exprimiert, die olfaktorische sensorische Neuronen sowie bestimmte Blutgefäß- und Stammzellpopulationen metabolisch und strukturell unterstützen .
Die Ergebnisse deuten darauf hin, dass eine Infektion nicht-neuronaler Zelltypen für die Anosmie bei Patienten mit COVID-19 verantwortlich sein könnte, und helfen bei den Bemühungen, den Krankheitsverlauf besser zu verstehen.
„Unsere Ergebnisse deuten darauf hin, dass das neue Coronavirus den Geruchssinn von Patienten verändert, nicht indem es Neuronen direkt infiziert, sondern indem es die Funktion unterstützender Zellen beeinträchtigt“, sagte der leitende Autor der Studie, Sandeep Robert Datta, außerordentlicher Professor für Neurobiologie. am Blavatnik-Institut der HMS.
Dies bedeute, dass es in den meisten Fällen unwahrscheinlich sei, dass eine SARS-CoV-2-Infektion die olfaktorischen Nervenschaltkreise dauerhaft schädige und eine anhaltende Anosmie verursachte, fügte Datta hinzu, eine Erkrankung, die mit einer Vielzahl von psychischen Problemen verbunden ist. und sozial, insbesondere Depressionen und Angstzustände.
„Ich denke, das sind gute Nachrichten, denn sobald die Infektion abgeklungen ist, müssen die Riechneuronen offenbar nicht ersetzt oder von Grund auf neu aufgebaut werden“, sagte er. „Aber wir brauchen mehr Daten und ein besseres Verständnis der zugrunde liegenden Mechanismen, um diese Schlussfolgerung zu bestätigen.“
Bei den meisten COVID-19-Patienten kommt es zu einem gewissen Grad an Anosmie, meist vorübergehend. Analysen elektronischer Krankenakten zeigen, dass bei Patienten mit COVID-19 die Wahrscheinlichkeit eines Geruchsverlusts 27-mal höher ist, die Wahrscheinlichkeit, dass sie an Fieber, Husten oder Atemnot leiden, jedoch nur 2,2- bis 2,6-mal höher als bei Patienten ohne COVID-19.
Einige Studien deuten darauf hin, dass sich die Anosmie bei COVID-19 von der Anosmie unterscheidet, die durch andere Virusinfektionen, einschließlich anderer Coronaviren, verursacht wird.
Beispielsweise erholen sich COVID-19-Patienten ihren Geruchssinn typischerweise im Laufe von Wochen, viel schneller als in den Monaten, die es dauern kann, sich von einer Anosmie zu erholen, die durch eine Untergruppe von Virusinfektionen verursacht wird, von denen bekannt ist, dass sie olfaktorische sensorische Neuronen direkt schädigen. .
Darüber hinaus verursachen viele Viren einen vorübergehenden Geruchsverlust, indem sie Probleme der oberen Atemwege, wie z. B. eine verstopfte Nase, auslösen. Bei einigen COVID-19-Patienten kommt es jedoch zu einer Anosmie ohne Nasenverstopfung .
Identifizieren Sie die Schwachstelle
In der aktuellen Studie wollten Datta und Kollegen besser verstehen, wie der Geruchssinn bei COVID-19-Patienten verändert wird, indem sie die Zelltypen identifizierten, die am anfälligsten für eine SARS-CoV-2-Infektion sind.
Sie begannen mit der Analyse vorhandener Einzelzellsequenzierungsdatensätze, die insgesamt die Gene katalogisierten, die von Hunderttausenden einzelnen Zellen in den oberen Nasenhöhlen von Menschen, Mäusen und nichtmenschlichen Primaten exprimiert wurden.
ace2-Animation: Rick Groleau
Das Team konzentrierte sich auf das ACE2-Gen , das in menschlichen Atemwegszellen weit verbreitet ist und das Hauptrezeptorprotein kodiert, auf das SARS-CoV-2 abzielt, um in menschliche Zellen einzudringen. Sie untersuchten auch ein anderes Gen, TMPRSS2 , das ein Enzym kodiert, von dem angenommen wird, dass es für den Eintritt von SARS-CoV-2 in die Zelle wichtig ist.
Analysen ergaben, dass sowohl ACE2 als auch TMPRSS2 von Zellen im Riechepithel exprimiert werden, einem speziellen Gewebe im Dach der Nasenhöhle, das für die Geruchserkennung verantwortlich ist und olfaktorische sensorische Neuronen und eine Vielzahl unterstützender Zellen beherbergt.
Allerdings wurde keines der Gene von olfaktorischen sensorischen Neuronen exprimiert. Stattdessen exprimierten diese Neuronen Gene, die mit der Fähigkeit anderer Coronaviren, in Zellen einzudringen, verbunden sind.
Die Forscher fanden heraus, dass zwei spezifische Zelltypen im Riechepithel ACE2 in ähnlichen Mengen exprimierten wie in Zellen der unteren Atemwege, den häufigsten Zielen von SARS-CoV-2, was auf eine Anfälligkeit für Infektionen hindeutet.
Dazu gehörten Sustainacular-Zellen, die sich um sensorische Neuronen wickeln und vermutlich für strukturelle und metabolische Unterstützung sorgen , sowie Basalzellen, die als Stammzellen fungieren und das Riechepithel nach einer Schädigung regenerieren. Das Vorhandensein von Proteinen, die von beiden Genen in diesen Zellen kodiert werden, wurde durch Immunfärbung bestätigt.
In weiteren Experimenten fanden die Forscher heraus, dass olfaktorische epitheliale Stammzellen das ACE2-Protein nach künstlich herbeigeführter Schädigung in höheren Mengen exprimierten als ruhende Stammzellen. Dies könnte auf eine zusätzliche Anfälligkeit für SARS-CoV-2 hinweisen, es sei jedoch unklar, ob dies für den klinischen Verlauf der Anosmie bei COVID-19-Patienten wichtig sei, sagten die Autoren.
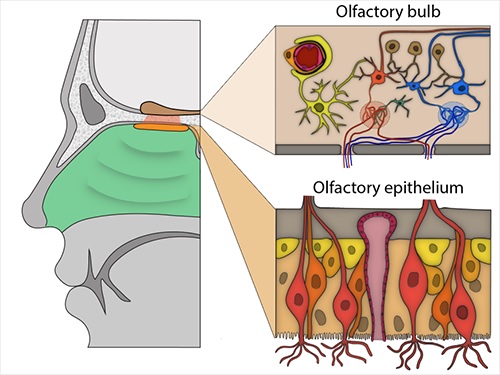
Riechkolben und Epithel. Wichtige Zellen: Oben rechts: Ein Perizyt (hellorange) umhüllt ein Blutgefäß (rot). Unten rechts: Riechsinnesneuronen (hellrot, orange), umgeben von Sustainakularzellen (braun) und Basalzellen (hellgelb und orange). Bild: Brann et. al., 2020.
Datta und seine Kollegen analysierten außerdem die Genexpression in fast 50.000 einzelnen Zellen im Riechkolben der Maus, der Struktur im Vorderhirn, die Signale von olfaktorischen Sinnesneuronen empfängt und für die anfängliche Geruchsverarbeitung verantwortlich ist.
Neuronen des Riechkolbens exprimierten kein ACE2.
Das Gen und das zugehörige Protein waren nur in Blutgefäßzellen vorhanden, insbesondere in Perizyten, die an der Regulierung des Blutdrucks, der Aufrechterhaltung der Blut-Hirn-Schranke und an Entzündungsreaktionen beteiligt sind. Kein Zelltyp des Riechkolbens exprimierte das TMPRSS2-Gen.
Hinweis auf Geruchsverlust
Zusammengenommen deuten diese Daten darauf hin, dass eine COVID-19-bedingte Anosmie durch einen vorübergehenden Verlust der unterstützenden Zellfunktion im Riechepithel entstehen könnte, der indirekt Veränderungen in den Riechsinnesneuronen verursacht, so die Autoren.
„Allerdings verstehen wir immer noch nicht ganz, was diese Änderungen sind“, sagte Datta. „Sustakularzellen wurden weitgehend ignoriert, und es scheint, dass wir ihnen Aufmerksamkeit schenken müssen, ähnlich wie wir die entscheidende Rolle, die Gliazellen im Gehirn spielen, immer mehr wertschätzen.“
Die Ergebnisse bieten auch interessante Hinweise auf die mit COVID-19 verbundenen neurologischen Probleme . Die Beobachtungen stimmen mit der Hypothese überein, dass SARS-CoV-2 Neuronen nicht direkt infiziert, sondern vielmehr die Gehirnfunktion beeinträchtigen kann, indem es Gefäßzellen im Nervensystem beeinflusst, sagten die Autoren. Dies erfordert weitere Untersuchungen, um dies zu überprüfen, fügten sie hinzu.
Die Studienergebnisse tragen nun dazu bei, die Bemühungen zu beschleunigen, den Geruchsverlust bei COVID-19-Patienten besser zu verstehen, was wiederum zu Behandlungen für Anosmie und der Entwicklung besserer geruchsbasierter Diagnostik für die Krankheit führen könnte.
„Anosmie scheint ein merkwürdiges Phänomen zu sein, aber sie kann für den kleinen Teil der Menschen, bei denen sie weiterhin auftritt, verheerende Folgen haben“, sagte Datta. „Es kann schwerwiegende psychologische Folgen haben und könnte ein großes Problem für die öffentliche Gesundheit darstellen, wenn wir eine wachsende Bevölkerung mit dauerhaftem Geruchsverlust haben.“
Das Team hofft auch, dass die Daten dazu beitragen können, den Weg für Fragen zum Krankheitsverlauf zu ebnen, beispielsweise ob die Nase als Reservoir für SARS-CoV-2 fungiert . Solche Bemühungen erfordern Studien in Einrichtungen, die Experimente mit lebenden Coronaviren und die Analyse menschlicher Autopsiedaten ermöglichen, die immer noch schwer zu erhalten sind, sagten die Autoren. Der kollaborative Geist der wissenschaftlichen Forschung im Zeitalter der Pandemie erfordert jedoch Optimismus.
„Wir haben mit dieser Arbeit begonnen, weil mein Labor zum Zeitpunkt des Ausbruchs der Pandemie einige Datensätze zur Analyse bereit hatte und wir einen ersten Vorabdruck veröffentlichten“, sagte Datta. „Was danach geschah, war erstaunlich: Forscher aus aller Welt boten uns an, ihre Daten in einer Art provisorischem globalen Konsortium zu teilen und mit uns zusammenzuführen. „Das war eine echte Gemeinschaftsleistung.“
Die ersten Co-Autoren der Studie sind David Brann, Tatsuya Tsukahara und Caleb Weinreb. Weitere Autoren sind Marcela Lipovsek, Koen Van den Berge, Boying Gong, Rebecca Chance, Iain Macaulay, Hsin-jung Chou, Russell Fletcher, Diya Das, Kelly Street, Hector Roux de Bezieux, Yoon-Gi Choi, Davide Risso, Sandrine Dudoit. Elizabeth Purdom, Jonathan Mill, Ralph Abi Hachem, Hiroaki Matsunami, Darren Logan, Bradley Goldstein, Matthew Grubb und John Ngai.
Die Studie wurde durch Zuschüsse der National Institutes of Health (Zuschüsse RO11DC016222 und U19 NS112953) und der Simons Collaboration on the Global Brain unterstützt. Weitere Förderinformationen finden Sie im Volltext des Dokuments. DOI: 10.1126/sciadv.abc1564