Hintergrund
Nitazoxanid ist weit verbreitet und übt in vitro eine breite antivirale Wirkung aus. Es gibt jedoch keine Hinweise auf eine Auswirkung auf die Infektion mit dem schweren akuten respiratorischen Syndrom Coronavirus 2 (SARS-CoV-2).
Methoden
In einer multizentrischen, randomisierten, doppelblinden, placebokontrollierten Studie wurden erwachsene Patienten eingeschlossen, die bis zu 3 Tage nach Ausbruch der Coronavirus-Krankheit 2019 (COVID-19) Symptome (trockener Husten, Fieber und/oder Müdigkeit) aufwiesen.
Nach Bestätigung einer SARS-CoV-2-Infektion durch Reverse-Transkriptase-PCR an einem Nasopharyngealabstrich wurden die Patienten im Verhältnis 1:1 randomisiert und erhielten 5 Tage lang dreimal täglich Nitazoxanid (500 mg) oder Placebo.
Das primäre Ergebnis war die vollständige Beseitigung der Symptome. Sekundäre Ergebnisse waren Viruslast, Labortests, Serum-Biomarker für Entzündungen und Krankenhauseinweisungsrate. Auch unerwünschte Ereignisse wurden ausgewertet.
Ergebnisse
Vom 8. Juni bis 20. August 2020 wurden 1.575 Patienten untersucht. Davon wurden 392 analysiert (198 Placebo, 194 Nitazoxanid). Die mittlere Zeit (Interquartilbereich) vom Einsetzen der Symptome bis zur ersten Dosis des Studienmedikaments betrug 5 (4–5) Tage.
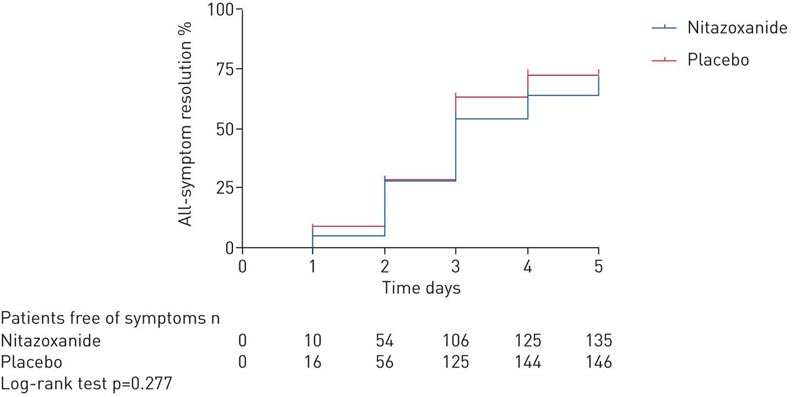
Beim 5-tägigen Studienbesuch unterschied sich die Symptomauflösung nicht zwischen dem Nitazoxanid- und dem Placebo-Arm.
Die entnommenen Abstriche waren bei 29,9 % der Patienten in der Nitazoxanid-Gruppe negativ auf SARS-CoV-2, gegenüber 18,2 % in der Placebo-Gruppe (p = 0,009).
Die Viruslast war nach Nitazoxanid im Vergleich zu Placebo reduziert (p = 0,006).
Die prozentuale Verringerung der Viruslast vom Ausgangswert bis zum Ende der Behandlung war unter Nitazoxanid (55 %) größer als unter Placebo (45 %) (p = 0,013).
Andere sekundäre Ergebnisse unterschieden sich nicht signifikant. Es wurden keine schwerwiegenden unerwünschten Ereignisse beobachtet.
Diskussion
In dieser multizentrischen, doppelblinden, randomisierten, placebokontrollierten Studie mit Patienten mit leichtem COVID-19 stellten wir fest, dass sich die Auflösung der Symptome (trockener Husten, Fieber und Müdigkeit) zwischen Nitazoxanid und Placebo nach 5 Tagen Therapie nicht unterschied.
Nitazoxanid war sicher, reduzierte die Viruslast deutlich und erhöhte den Anteil der Patienten, die nach 5-tägiger Therapie negativ auf SARS-CoV-2 getestet wurden, im Vergleich zu Placebo. Nitazoxanid verhinderte weder einen Krankenhausaufenthalt noch verursachte es irgendwelche Veränderungen im Blutbild, im CRP-Spiegel oder bei Serum-Biomarkern für Entzündungen. Darüber hinaus ist Nitazoxanid kostengünstig und weit verbreitet, und bisher konnte nicht nachgewiesen werden, dass andere empfohlene Therapien bei dieser Patientengruppe einen Nutzen bringen.
Es besteht ein dringender Bedarf an evidenzbasierten Pharmakotherapeutika für COVID-19. Im herausfordernden Kontext einer Pandemie kann die Wiederverwendung von Arzneimitteln den zeitaufwändigen Arzneimittelentwicklungsprozess verkürzen und eine schnelle Bereitstellung wirksamer Therapien für die Bevölkerung ermöglichen.
Vor der Durchführung dieser Studie wurde die Bibliothek der National Institutes of Health Clinical Collection, eine Sammlung von 727 von der US-amerikanischen Food and Drug Administration (FDA) zugelassenen Arzneimitteln oder arzneimittelähnlichen Verbindungen, die in klinischen Studien am Menschen verwendet wurden, untersucht antivirale In-vitro-Aktivität gegen SARS-CoV-2 (Ergänzende Abbildung S1). Nitazoxanid und Tizoxanid, sein aktiver Metabolit, reduzierten die Viruslast in Vero E6, menschlichen embryonalen Nierenzellen (HEK 293T) und Lungenepithelzellen (Calu-3), die mit SARS-CoV-2 infiziert waren, erheblich, ohne dass es zu einem Verlust der Lebensfähigkeit der Zellen kam.
Das Nebenwirkungsprofil von Nitazoxanid ist gut bekannt, da es seit 1996 im Handel erhältlich ist und klinisch eingesetzt wird; Tatsächlich wurde in diesem Versuch eine kommerzielle Formulierung verwendet. Für die Behandlung von Darmparasitose ist ein Dosierungsschema von 500 mg alle 12 Stunden zugelassen und wird häufig verschrieben, wobei nur wenige unerwünschte Ereignisse berichtet wurden.
In unserer Studie wurde die gleiche Dosis verabreicht, jedoch alle 8 Stunden, basierend auf den pharmakologischen In-vitro-Studien unserer Gruppe und veröffentlichten Daten zur Plasmakonzentration, um die potenzielle Hemmung von SARS-CoV-2 in vivo zu maximieren. Wir gingen davon aus, dass hohe Verhältnisse der maximalen Serumkonzentration bei sicheren Dosen beim Menschen und der maximal wirksamen antiviralen Konzentration in vitro zu einem größeren Potenzial zur Virussuppression bei zugelassenen Dosen führen würden.
Nitazoxanid erreichte das primäre Ergebnis bei Patienten mit leichtem COVID-19 nicht, als es nach 5 Behandlungstagen beurteilt wurde. In Übereinstimmung mit In-vitro-Daten beobachteten wir nach einer 5-tägigen Behandlung mit Nitazoxanid bei Patienten mit leichtem COVID-19 eine signifikante Verringerung der Viruslast. Dieser Effekt kann epidemiologische Auswirkungen haben und möglicherweise die Verbreitung von SARS-CoV-2 in der Gemeinschaft sowie die Morbidität und Mortalität verringern.
Schlussfolgerungen Bei Patienten mit leichtem COVID-19 unterschied sich das Verschwinden der Symptome zwischen der Nitazoxanid- und der Placebo-Gruppe nach fünf Behandlungstagen nicht. Allerdings war eine frühe Therapie mit Nitazoxanid sicher und reduzierte die Viruslast deutlich. |